1、选择题 已知几种难溶电解质的溶度积常数(25℃)见下表
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4
Ksp
1.8×10-10
5.4×10-13
8.5×10-17
1.4×10-5
1.12×10-12
|
下列对AgCl、AgBr、AgI、Ag2SO4、Ag2CrO4叙述不正确的是( )
A.Ksp的大小与三种卤化银见光分解的难易无关
B.将等体积的4×10-3mo1?L-1的AgNO3和4×10-3mo1?L-1K2CrO4混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液
D.100mL0.1mol?L-1的Na2SO4溶液中加入1mL0.1mol?L-1的AgNO3溶液,有白色沉淀生成
参考答案:A.溶解性属于物理性质,见光分解属于化学性质,Ksp的大小与三种卤化银见光分解的难易无关,故A正确;
B.由离子的浓度可知,(2×10-3)2×(2×10-3)=8×10-9>1.12×10-12,所以有Ag2CrO4沉淀产生,故B正确;
C.由表格中的Ksp可知,1.8×10-10>8.5×10-17,则AgI的溶度积比AgCl小,所以向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液,故C正确;
D.由离子浓度可知,0.1×(0.001)2=10-7<1.4×10-5,则没有白色沉淀生成,故D错误;
故选D.
本题解析:
本题难度:一般
2、填空题 最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下
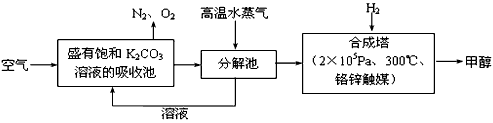
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式____________________________;下列措施中能使n(CH3OH)/n(CO2)增大的是
___________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。 已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O
则阴极反应为:____________________。
(3)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)_________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(4)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为
4.96×10-9、2.58×10-9。应该选用的试剂是_____________________。
参考答案:(1)CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol; CD?
(2)2CO2+4e-+2H2O=2CO+4OH-
(3)>;因为既存在HCO3-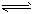 CO32-+H+也存在HCO3-+H2O
CO32-+H+也存在HCO3-+H2O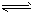 H2CO3+OH-而HCO3-的水解程度大于电离程度
H2CO3+OH-而HCO3-的水解程度大于电离程度
(4)Ba(OH)2(或NaOH溶液和BaCl2溶液)
本题解析:
本题难度:困难
3、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
[? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知Ksp[Al(OH)3]=1.3×10-33 mol4·L-4, Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4。现向pH=0浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入NaOH溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是(?)

参考答案:B
本题解析:依据已知的Ksp[Al(OH)3]=1.3×10-33 mol4·L-4、Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4,可以求得Cu2+和Fe3+完全以氢氧化物沉淀时(即金属离子浓度小于10-5mol·L-1时)的pH分别为:4.7和3.2;现在向pH=0浓度均为0.04mol?L-1的Al3+、Fe3+溶液中,调节PH值,(设溶液体积不变),所以氢氧化钠溶液提高溶液PH到3.2,氢氧根离子浓度增大,使Qc大于Ksp,三价铁离子能沉淀完全,根据Ksp[Fe(OH)3]=4.0×10-38,=[Fe3+][OH-]3,计算得[OH-]=10-12mol/L;三价铁离子开始生成沉淀的PH=2,所以铁离子开始沉淀到沉淀完全的PH范围为2-3.2过程中该过程中Al3+、Fe3+的浓度与pH关系依据图象和反应原理判断,当PH=2时,铁离子开始沉淀,故B选项正确。
本题难度:一般
5、选择题 难溶物质在水中达到溶解平衡的溶度积常数与水的电离平衡常数相似。则关于BaSO4溶解平衡: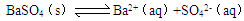 的下列说法正确的是(?)
的下列说法正确的是(?)
A.溶液的温度升高,BaSO4的溶度积常数不变
B.在Na2SO4溶液中,BaSO4的溶解度不变
C.在BaCl2溶液中,BaSO4的溶度积常数变小
D.精制NaCl时,在溶液中加入稍过量的BaCl2溶液是为了更好地除去SO42-等离子
参考答案:D
本题解析:溶度积常数受温度的影响,与离子浓度无关,则A、C错;在Na2SO4溶液中及在BaCl2溶液中溶解平衡均向逆向移动,则B错D正确。
本题难度:一般