1、选择题 下列反应中,氧化反应与还原反应在同一种元素中进行的是(? )
A.Zn+H2SO4===ZnSO4+H2↑
B.2FeCl2+Cl2===2FeCl3
C.2KClO3 2KCl
2KCl +3O2↑
+3O2↑
D.Cl2+H2O===HClO+HCl
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列有关表述中正确的是(?)
A. 的电子排布式可简写为
的电子排布式可简写为
B.16O与18O互为同位素,H216O、H218O互为同素异形体
C.CH4、 粒子的空间构型均为正四面体形
粒子的空间构型均为正四面体形
D.NH4Cl的电子式为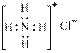
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列说法不正确的是?(?)
A.标准状况下,等体积的CH4和CO2分子数相等
B.与NaOH溶液、稀硫酸反应产生等量的H2,所需铝粉的质量相等
C.常温下,铜与浓硫酸迅速反应产生SO2气体
D.1mol OH- 和17g NH3所含的电子数相等
参考答案:C
本题解析:略
本题难度:简单
4、选择题 如图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两
容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
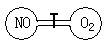
A.增大
B.减小
C.不变
D.无法确定
参考答案:C
本题解析:打开活塞前容器内气体密度相同,则气体质量是连通器的体积与密度的乘积;打开活塞,连通器的体积不变,连通器内的气体的质量不变,所以密度仍是反应前的密度,不变,答案选C。
本题难度:简单
5、填空题 (12分)金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 ,其总反应式为: 。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g) △H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
参考答案:(12分)
(1)b d (2分)
(2) Cu2S, 4 (各1分)
(3)a (1分), NO3— + 2H+ + e— =NO2 ↑+H2O(2分)
(4)①导电(或做电解质溶液),②水参与了化学反应(答出其中任一点即得1分), 3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag (2分)
(5)-25kJ/mol (2分)
本题解析:(1)采用电解法进行冶炼的金属一般是较活泼的金属,如电解熔融的氯化钠、氧化铝来制取钠、铝,制取铁、铜通常采用还原法,所以答案选bd;
(2)2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O中,还原剂是元素化合价升高的元素,所以Cu元素的化合价从+1价升高到+2价,所以Cu2S作还原剂;当1molO2发生反应时,还原剂失去电子的物质的量也是氧化剂得到电子的物质的量,该反应的氧化剂是氧气,1mol氧气反应时得到4mol电子,所以还原剂失去电子的物质的量是4mol;
(3)电解精炼银时,粗银作阳极,纯银座阴极,阳极与电源的正极相连,所以a为粗银,b极产生红棕色气体,则红棕色气体为二氧化氮,说明部分的硝酸根离子发生还原反应生成二氧化氮,电极反应式为NO3— + 2H+ + e— =NO2 ↑+H2O;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,使Al、Ag2S、食盐水构成原电池,则Al作电池的负极发生氧化反应,则Ag2S发生还原反应,被还原为Ag,所以食盐水作电解质溶液,起导电的作用,同时水也参与了反应,总反应为Al与水、Ag2S发生氧化还原反应生成Ag、氢氧化铝、硫化氢,化学方程式为3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag;
(5)根据盖斯定律,将所求 热化学方程式中未出现的物质消去,则所求的热化学方程式为(②+2③+6①)/3,所以Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H=[(-47KJ/mol)+2×(+19KJ/mol)+6×(-11KJ/mol)]/3=-25kJ/mol。
考点:考查氧化还原反应的分析,电解原理的应用,盖斯定律的应用,
本题难度:困难