|
高考化学知识点整理《热化学方程式》考点强化练习(2019年押题版)(四)
2019-05-30 05:21:57
【 大 中 小】
|
1、填空题 (1)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气.已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
则肼与二氧化氮反应的热化学方程式为:______
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点.氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O.酸式氢氧燃料电池的电解质溶液是强酸溶液,负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为______;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e-=4OH-,则其负极反应式为______.
参考答案:(1)25℃时,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.氢氧化铜的溶度积常数小于氢氧化镁的溶度积常数.
所以在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成氢氧化铜沉淀.
反应的化学方程式是:CuCl2+2NH3?H2O=Cu(OH)2↓+2NH4Cl,NH3?H2O是弱碱,不能拆,Cu(OH)2是弱碱不能拆.
故离子方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2 ; Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;
(2)根据盖斯定律,将(2×①)+(2×②)可知:
肼与二氧化氮反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol;
(3)氢氧燃料电池无论是酸式还是碱式,其电池总反应均为:2H2+O2=2H2O ①
酸式氢氧燃料电池负极电极反应式为:2H2-4e-=4H+②
用(①-②)即得酸式氢氧燃料电池的正极反应:O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的正极电极反应式为:O2+2H2O+4e-=4OH-③
用(①-③)即得:2H2-4e-+4OH-=4H2O,故碱式氢氧燃料电池的负极反应:H2-2e-+2OH-=2H2O,
故答案为:O2+4e-+4H+=2H2O;H2-2e-+2OH-=2H2O.
本题解析:
本题难度:一般
2、填空题 (10分)工业上制备BaCl2的工艺流程图如图:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s)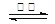 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ① 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)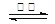 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ② 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
A.Na2S溶液的pH比NaHS溶液pH小
B.两溶液中含有的离子种类不同
C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D.两溶液中加入NaOH固体,c(S2-)都增大
| E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+)
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,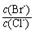 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)反应C(s) + CO2(g)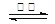 2CO(g)的ΔH = 2CO(g)的ΔH =
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
参考答案:(1)S2-+H2O HS-+OH-;D、E;(2)2.7×10-3;(3)+172.5KJ/mol;(4)炭过量使BaSO4充分还原 HS-+OH-;D、E;(2)2.7×10-3;(3)+172.5KJ/mol;(4)炭过量使BaSO4充分还原
本题解析:(1)①BaSO4与焦炭在高温下发生反应产生BaS,BaS与盐酸发生反应:BaS+2HCl=BaCl2+H2S↑。H2S 气体被NaOH溶液吸收得到Na2S。Na2S是强碱弱酸盐,弱酸根离子水解使溶液显碱性。水解的离子方程式为S2-+H2O HS-+OH-。②A.NaHS是H2S 的一级电离产生的,Na2S是H2S 的二级电离产生的,对于多元弱酸来说,一级电离>>二级电离。溶液的酸性主要一级电离决定。根据盐的水解规律:有弱才水解,谁弱谁水解,,越弱越水解,谁强显谁性。所以溶液的碱性Na2S>NaHS。即Na2S溶液的pH比NaHS溶液pH大。错误。B.在两种物质的溶液中都含有Na+、S2-、HS-、H2S、H+、OH-。离子种类相同。错误。C.当向Na2S溶液中加入盐酸时,首先发生S2-+H+=HS-,没有气体产生;然后发生HS-+H+=H2S↑,放出气体。而向NaHS溶液中加入盐酸时立即发生HS-+H+=H2S↑,放出气体。所以两溶液中滴入同体积同浓度的盐酸,产生气体速率不相等。错误。D.当向Na2S和NaHS的溶液中分别加入NaOH溶液时由于增大了OH-离子的浓度,所以水解平衡:S2-+H2O HS-+OH-。②A.NaHS是H2S 的一级电离产生的,Na2S是H2S 的二级电离产生的,对于多元弱酸来说,一级电离>>二级电离。溶液的酸性主要一级电离决定。根据盐的水解规律:有弱才水解,谁弱谁水解,,越弱越水解,谁强显谁性。所以溶液的碱性Na2S>NaHS。即Na2S溶液的pH比NaHS溶液pH大。错误。B.在两种物质的溶液中都含有Na+、S2-、HS-、H2S、H+、OH-。离子种类相同。错误。C.当向Na2S溶液中加入盐酸时,首先发生S2-+H+=HS-,没有气体产生;然后发生HS-+H+=H2S↑,放出气体。而向NaHS溶液中加入盐酸时立即发生HS-+H+=H2S↑,放出气体。所以两溶液中滴入同体积同浓度的盐酸,产生气体速率不相等。错误。D.当向Na2S和NaHS的溶液中分别加入NaOH溶液时由于增大了OH-离子的浓度,所以水解平衡:S2-+H2O HS-+OH-、HS-+H2O HS-+OH-、HS-+H2O H2S+OH-逆向移动。使c(S2-)都增大。所以正确。E.NaHS=Na++ HS-; HS-发生水解反应 HS-+H2O H2S+OH-逆向移动。使c(S2-)都增大。所以正确。E.NaHS=Na++ HS-; HS-发生水解反应 HS-+H2O H2S+OH-要消耗,所以c(Na+) >c(HS-);HS-水解消耗了水电离产生的H+,使H+的浓度减小,最终当达到水的电离平衡时c(OH-) >c (H+) 。盐的电离远大于弱电解质水的电离,所以c(HS-) >c(OH-)。因此E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+) 。正确。(2)向BaCl2溶液中加入AgNO3和KBr,发生反应:Ag++Cl-="AgCl↓;" Ag++Br-=AgBr↓.Ksp(AgBr)= C(Ag+)·C(Br-) =5.4×10-13; Ksp(AgCl)= C(Ag+)·C(Cl-)=2.0×10-10当两种沉淀共存时,C(Ag+)相同。 H2S+OH-要消耗,所以c(Na+) >c(HS-);HS-水解消耗了水电离产生的H+,使H+的浓度减小,最终当达到水的电离平衡时c(OH-) >c (H+) 。盐的电离远大于弱电解质水的电离,所以c(HS-) >c(OH-)。因此E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+) 。正确。(2)向BaCl2溶液中加入AgNO3和KBr,发生反应:Ag++Cl-="AgCl↓;" Ag++Br-=AgBr↓.Ksp(AgBr)= C(Ag+)·C(Br-) =5.4×10-13; Ksp(AgCl)= C(Ag+)·C(Cl-)=2.0×10-10当两种沉淀共存时,C(Ag+)相同。 。(3) (①-②)÷2可得:反应C(s) + CO2(g) 。(3) (①-②)÷2可得:反应C(s) + CO2(g) 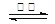 2CO(g)的ΔH =+172.5KJ/mol;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4充分还原得到BaS。 2CO(g)的ΔH =+172.5KJ/mol;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4充分还原得到BaS。
考点:考查BaSO4的用途、Na2S和NaHS溶液的比较、溶度积常数的应用及热化学方程式的书写等知识。
本题难度:一般
3、填空题 (15分)X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的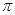 键与 键与 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) ?H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g)?H=-196.46KJ/mol
③H2(g)+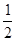 O2(g)= H2O(l) ?H=" -285.84" KJ/mol O2(g)= H2O(l) ?H=" -285.84" KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为
参考答案:(1)第二周期第ⅣA族 [Ar]3d9
(2)S2— HO分子间能形成氢键,分子间作用力较大,沸点较高
(3)强 H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
(4)1∶1 HCO3—+OH—=CO32—+H2O
(5)Cu(s)+H2O2(l)+2H+(aq)=Cu2+ (aq)+2H2O(l) △H=-319.68kJ/mol
本题解析:X元素原子核外有三个能级,各能级电子数相等,则X 是C元素;Y的单质在空气中燃烧生成一种淡黄色的固体,则Y是Na元素;Z元素原子的最外层电子数比次个层电子少数2,则Z是S元素;W的内层电子已充满,最外层只有一个电子,则Z是Cu元素。(1)X元素在周期表中的位置是第二周期第ⅣA族;29号元素Cu的离子的核外电子排布式是[Ar]3d9;(2)Y离子和Z离子比较,前者是2、8的电子层结构,后者是2、8、8的电子层结构,离子核外电子层数越多,离子半径越大,所以两种离子中半径较大的是S2-;H2O、H2S都是分子晶体,分子间通过分子间作用力结合,而水的分子之间除了分子间作用力外,还存在氢键,增加了分子之间的作用力,所以水的熔沸点比H2S高。(3)Z元素的非金属性比X强,这可以根据元素的最高价氧化物对应的水化物的酸性强弱比较,用方程式表示是:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;(4)X与Z形成的三原子化合物CS2是共价化合物,结构类型CO2,结构式是S=C=S,该化合物分子中的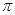 键与 键与 键的个数之比是2:2=1:1;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为HCO3—+OH—=CO32—+H2O;(5)①+②÷2+③,整理可得:Cu(s)+H2O2(l)+2H+(aq)=Cu2+ (aq)+2H2O(l) △H=-319.68kJ/mol。 键的个数之比是2:2=1:1;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为HCO3—+OH—=CO32—+H2O;(5)①+②÷2+③,整理可得:Cu(s)+H2O2(l)+2H+(aq)=Cu2+ (aq)+2H2O(l) △H=-319.68kJ/mol。
考点:考查元素的推断、元素在周期表中的位置、核外电子排布、离子半径比较、氢键、元素非金属性的比较、物质分子中化学键、反应的离子方程式和热化学方程式的知识。
本题难度:困难
4、填空题 (1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为______.
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,写出该反应的热化学方程式______.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(g)的△H=______.
参考答案:(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,则该燃烧反应的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),
则△H=(-285.8kJ/mol)×2-(-43.992kJ/mol)×2=-483.6kJ/mol,
故答案为:H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol;-483.6kJ/mol.
本题解析:
本题难度:一般
5、填空题 CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下: CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
| 初始投料
| 2 molH2、1 molCO
| 1 mol CH3OH
| 4 molH2、2 molCO
| 平衡时n(CH3OH )
| 0.5mol
| n2
| n3
| 反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
| 体系的压强
| P1
| P2
| P3
| 反应物的转化率
| α1
| α2
| α3
|
①该温度下此反应的平衡常数K为 。
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
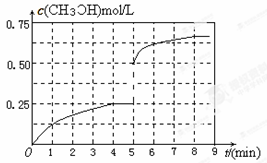
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。

(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
参考答案:(1)2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol
(2)正极:O2+4e-+2CO2=2CO32-
(3)①4;②AB;③如图:
(4)③>④>②>①;cd
本题解析:(1)利用盖斯定律,将所给反应I+反应II-反应III可得2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol。
(2)以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,该燃料电池的正极反应为O2+4e-+2CO2=2CO32-。
(3)①根据表格数据(甲组实验),利用三段式可得:
2H2(g)+CO(g) CH3OH(g) CH3OH(g)
起始浓度(mol/L):1 0.5 0
变化浓度(mol/L):0.5 0.25 0.25
平衡浓度(mol/L):0.5 0.25 0.25
所以平衡常数K=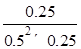 =4; =4;
②恒温恒容条件下,实验甲和实验乙为等效平衡,甲为从正反应方向进行,乙为从逆反应方向进行,故两种情况下反应物的转化率α1+α2=1,反应放出和吸收的热量数值之和Q1+Q2=d;实验丙反应物是甲的2倍,相当于增大压强,则平衡向正反应方向移动,使反应物转化率增大,α3>α1,平衡时n3>1.0mol,P3<2P1,Q3>2Q1,故选AB。
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,压缩的瞬间,甲醇的浓度为原来的2倍,然后平衡向正反应方向移动,使甲醇浓度进一步增大,直至平衡,据此可作出CH3OH的物质的量浓度的变化曲线图像。
(4)根据题给信息可知甲酸的酸性比乙酸强,故HCOONa溶液比CH3COONa溶液水解程度小,所以四种溶液的pH由大到小的顺序为③>④>②>①;对于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液,根据物料守恒c(HCOOˉ)+c(HCOOH)=" 0.1" mo1/L;电荷守恒为c(HCOOˉ)+ c(OHˉ)=c(Na+)+c(H+),又溶液呈酸性,所以c(H+)>c(OHˉ),故c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ),将物料守恒和电荷守恒联立,可得c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+),综上,cd正确。
考点:考查盖斯定律、燃料电池电极反应式书写、化学平衡、盐类水解等相关知识。
本题难度:困难
| 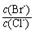 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】 2CO(g)的ΔH =
2CO(g)的ΔH = 