1、选择题 下列有关二氧化硅的叙述中不正确的是
A.沙子、石英、水晶的主要成分都是SiO2
B.SiO2是制光导纤维的主要原料
C.硅酸可由SiO2直接制得
D.SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应
参考答案:C
本题解析:A、沙子、石英、水晶的主要成分都是SiO2,A正确;B、二氧化硅可以用制作光导纤维,B正确;C、二氧化硅是酸性氧化物,但不能与水反应生成硅酸,C不正确;D、SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应,例如二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,在加热的条件下与生石灰反应生成硅酸钙,D正确,答案选C。
本题难度:一般
2、选择题 某二价金属的碳酸盐和碳酸氢盐的混合物跟足量盐酸反应时消耗的H+和产生CO2的物
质的量之比为5∶4,该混合物中碳酸盐和碳酸氢盐的物质的量之比为
A.1∶2
B.2∶3
C.3∶4
D.4∶5
参考答案:B
本题解析:设二价金属为M,混合物中碳酸盐(MCO3)和碳酸氢盐〔M(HCO3)2〕的物质的量分别为x和y,由题意可知:







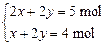 ?解得
?解得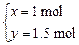 ?x∶y=2∶3
?x∶y=2∶3
本题难度:简单
3、选择题 把过量的CO2通入下列溶液中,最后仍有白色沉淀的是 ( )
A.Na2SiO3溶液
B.CaCl2溶液
C.Ca(OH)2溶液
D.NaOH溶液
参考答案:A
本题解析:A:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3
B:CO2与CaCl2溶液不发生反应
C:生成碳酸钙沉淀后,继续通入气体,沉淀溶解
D:无沉淀生成
答案为A
本题难度:简单
4、填空题 (10分)(1)用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
①光导纤维的主要成分是?;
②目前应用最多的太阳能电池的光电转化材料是?。
(2)氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取。粉末状Si3N4对空气和水都不稳定。但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到对水不稳定的Mg3N2。
①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式:?;
②在Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理的过程中,发生反应,反应过程中有Mg3N2生成。其化学方程式为:?;
③氮化硅Si3N4是一种高温结构材料,其优点是(只要求写出二种)。
?、?
参考答案:(1)①SiO2;②Si。(2)①3SiCl4+4NH3=Si3N4+12HCl;②Si3N4+6MgO=3SiO2+2Mg3N2;
③抗氧化、耐磨损、抗腐蚀、润滑性、抗冷热冲击等
本题解析:略
本题难度:一般
5、实验题 单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式?。
(2)装置C中的试剂是?;装置F的作用是?;
装置E中的h瓶需要冷却的理由是?。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:?。
②滴定前是否要滴加指示剂??(填“是”或“否”),请说明理由?。
③滴定前检验Fe3+是否被完全还原的实验操作是?。
参考答案:(1)MnO2+4H++2Cl- ?Mn2++Cl2↑+2H2O(2分)
?Mn2++Cl2↑+2H2O(2分)
(2)浓硫酸(2分);
防止空气中的水进入H中;产物SiCl4沸点低,需要冷凝收集(2分)
(3)①5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
②否;KMnO4溶液的紫红色可指示反应终点;(2分)
③取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原(2分)
本题解析:(1)装置A为制取氯气的装置,所以发生的离子反应方程式为MnO2+4H++2Cl- ?Mn2++Cl2↑+2H2O;
?Mn2++Cl2↑+2H2O;
(2)装置B为除去氯气中的氯化氢,所以装置C中的试剂是浓硫酸,干燥氯气;四氯化硅遇水易水解,所以装置F的作用是防止空气中的水进入H中;产物SiCl4沸点低,需要冷凝收集,所以h瓶需要冷却;
(3)①亚铁离子与酸性高锰酸钾反应被氧化成铁离子,高锰酸钾被还原成锰离子,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前不用加任何指示剂,因为高锰酸钾溶液本身为紫红色溶液,可用高锰酸钾溶液的颜色判断反应终点;
③Fe3+的检验通常用KSCN溶液,取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原。
本题难度:一般