1、选择题 下列离子组一定能大量共存的是
A.遇苯酚显紫色的溶液中:I-、AlO2-、SCN-、Mg2+
B.使pH试纸变为蓝色的溶液中:Na+、C1-、S2-、ClO-
C.c(HCO3-)=0.1mol/L的溶液中:NH4+、K+、SO32-、Br-
D.常温下水电离产生的c(H+)、c(OH-)满足c(H+)?c(OH-)=10-24:Mg2+、NH4+、SO42-、NO3-
参考答案:C
本题解析:分析:根据离子之间能否结合生成络离子、能否发生氧化还原反应、能否相互促进水解,能否结合生成沉淀等来判断离子组共存问题,并注意隐含信息的应用.
解答:A、遇苯酚显紫色的溶液中含有Fe3+,Fe3+与I-发生氧化还原反应,Fe3+与AlO2-相互促进水解,Fe3+与SCN-结合生成络离子,则不能大量共存,故A错误;
B、使pH试纸变为蓝色的溶液中有较多的OH-,碱性条件下S2-、ClO-发生氧化还原反应,则不能大量共存,故B错误;
C、c(HCO3-)=0.1mol/L的溶液中不会存在酸或碱电离的H+、OH-,则该组离子之间不反应,能大量共存,故C正确;
D、常温下水电离产生的c(H+)、c(OH-)满足c(H+)?c(OH-)=10-24,说明水的电离受到抑制,则溶液可能为酸或碱的溶液,则碱性条件下Mg2+、NH4+分别转化为沉淀、弱电解质,则不能大量共存,故D错误;
故选C.
点评:本题考查离子的共存问题,明确常见离子的性质及离子之间的反应即可解答,此类习题应注意隐含信息的挖掘和应用是解答的关键.
本题难度:一般
2、选择题 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量的关系如图所示则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
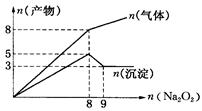
A.2 mol、3 mol、8 mol
B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、4 mol
参考答案:C
本题解析:2Na2O2 + 2H2O =" 4NaOH" + O2↑?分析图中拐点可以得出,当Na2O2的量为8mol时产生4mol氧气,Al3+、Mg2+、NH4+反应完全,到9mol时,氢氧化铝溶解完全,故有
n(Al3+)=n(Al(OH)3)=2mol
n(NH4+)=n(NH3)=8-4=4mol
n(Mg2+)=n(Mg(OH)2)=3mol
本题难度:一般
3、选择题 无论是在强酸性条件还是强碱性条件下,下列各组离子均不能大量共存的有下列的
①MnO4-、SO42-、K+、Fe2+
②NO3-、lO-、Ag+、Ca2+
③[Al(OH)4]-、CO32-、Na+、NO3-
④[Al(OH)4]-、HCO3-、NH4+、SO42-
A.共1组
B.共2组
C.共3组
D.全部
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.Ca(HCO3)2+与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.NaCO3溶液中通入过量CO2:CO32-+CO2+H2O=2HCO3-
D.CH3COOH溶液与NaOH溶液反应:H++OH-=H2O
参考答案:C
本题解析:
本题难度:简单
5、选择题 烧杯中盛有100 mL 0.1 mol/L的NaHSO4溶液,向其中逐滴滴加0.1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如下图。下列说法正确的是

[? ]
A.曲线a表示H+的物质的量的变化
B.直线d表示OH-的物质的量的变化
C.曲线c表示Ba2+的物质的量的变化
D.加入Ba(OH)2溶液50 mL,反应的离子方程式为 Ba2++OH-+H++SO42-=BaSO4↓+H2O
参考答案:B
本题解析:
本题难度:一般