1、选择题 下列各组离子在溶液中能大量共存的是
A.Cu2+、C1—、Na+
B.H+、Cl—、CO32—
C.Ba2+、Na+、SO42—
D.H+、K+、OH—
参考答案:A
本题解析:B项:H+、、CO32—反应生成二氧化碳和水,不能共存,故错;C项:Ba2+、SO42—反应生成沉淀,不能共存,故错;D项:H+、、OH—反应生成水,不能共存,故错。故选A。
点评:本题考查的是离子共存的知识,题目难度不大,复分解反应其实是离子间的反应,离子间不能形成水、气体或沉淀,离子可以共存。
本题难度:简单
2、选择题 类比推理是化学学习中的一种重要方法.下列类推结论正确的是( )
| 类比对象 | 结论
A
Cl2+H2O=HCl+HClO
F2+H2O=HF+HFO
B
MgCl2Mg+Cl2↑
2AlCl32Al+3Cl2↑
C
CH4+Cl2CH3Cl+HCl
CH2=CHCH3+Cl2CH2=CHCH2Cl+HCl
D
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO
|
A.A
B.B
C.C
D.D
参考答案:A、F2具有强氧化性,与水反应生成氧气和HF,反应的方程式为2F2+2H2O=4HF+O2,故A错误;
B、Al元素的金属性较弱,AlCl3为共价化合物,熔融状态下不导电,应用电解氧化铝的方法冶炼金属铝,故B错误;
C、烃类物质在光照条件下发生取代反应,而烯烃可与溴水或溴的四氯化碳溶液发生加成反应,故C正确;
D、HClO具有强氧化性,而SO2具有还原性,二者发生氧化还原反应,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 某溶液中所含离子及其浓度如下表,则Mn+及a值可能为
所含离子
| NO3-
| SO42-
| H+
| Na+
| Mn+
|
浓度(mol/L)
| 3
| 1
| 2
| 1
| A
|
A.Mg2+、1? B.Ba2+、0.5? C.Al3+、1.5? D.Fe2+、 2
参考答案:A
本题解析:根据电荷守恒可知,―3―2+2+1+nA="0," nA=2,选项A正确,其余都是错误的,答案选A。
本题难度:一般
4、填空题 (7分)(1)往铜和稀硫酸的混合物中加入双氧水溶液,可以观察到的实验现象是:溶液变蓝,并产生无色气体,请写出涉及这一现象的所有化学反应方程式:
, ?。
(2)两个氧化还原反应的离子方程式如下:
① R3++Cl2+6OH-=RO3-+2Cl-+3H2O
② 5RO3-+2Mn2++14H+=5R3++2MnO4-+7H2O
由此 (填“能”或“不能”)得出Cl2的氧化性比MnO4-强的结论,理由是 。
参考答案:

本题解析:(1)在酸性溶液中,双氧水能将铜氧化,其反应方程式为: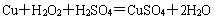 ,反应后生成的铜离子可作为双氧水分解时的催化剂作用,所以,并产生无色气体的反应方程式为:
,反应后生成的铜离子可作为双氧水分解时的催化剂作用,所以,并产生无色气体的反应方程式为: ;
;
(2)上述两个反应由于不在同一条件下进行的反应,所以,不能得出Cl2的氧化性比MnO4-强的结论;
本题难度:简单
5、选择题 向亚硫酸氢铵溶液中逐滴加入一定量NaOH溶液,以下为实验过程中发生反应的离子方程式,其中错误的是
A.NH4++2HSO3-+3OH-→NH3?H2O+2SO32-+2H2O
B.NH4++HSO3-+2OH-→NH3?H2O+SO32-+H2O
C.2NH4++HSO3-+3OH-→2NH3?H2O+SO32-+H2O
D.2NH4++5HSO3-+7OH-→2NH3?H2O+5SO32-+5H2O
参考答案:C
本题解析:分析:向亚硫酸氢铵溶液中逐滴加入一定量NaOH溶液,首先发生反应OH-+HSO3-=SO32-+H2O,HSO3-反应完毕,剩余的OH-再与NH4+发生反应NH4++OH-=NH3?H2O,亚硫酸氢铵溶液中n(NH4+)=n(HSO3-)(不考虑水解),故离子方程式中HSO3-的系数大于或等于NH4+的系数,结合选项判断.
解答:向亚硫酸氢铵溶液中逐滴加入一定量NaOH溶液,首先发生反应OH-+HSO3-=SO32-+H2O,HSO3-反应完毕,剩余的OH-再与NH4+发生反应NH4++OH-=NH3?H2O,亚硫酸氢铵溶液中n(NH4+)=n(HSO3-)(不考虑水解),故离子方程式中HSO3-的系数大于或等于NH4+的系数,
A、NH4++2HSO3-+3OH-=NH3?H2O+2SO32-+2H2O中发生反应2OH-+2HSO3-=2SO32-+2H2O、NH4++OH-=NH3?H2O,亚硫酸氢铵与氢氧化钠物质的量之比为2:3,铵根离子未完全反应,符合反应,故A正确;
B、NH4++HSO3-+2OH-=NH3?H2O+SO32-+H2O中发生反应OH-+HSO3-=SO32-+H2O、NH4++OH-=NH3?H2O,亚硫酸氢铵与氢氧化钠物质的量之比为1:2,二者恰好完全反应,故B正确;
C、2NH4++HSO3-+3OH-=2NH3?H2O+SO32-+H2O表示首先发生反应NH4++OH-=NH3?H2O,故C错误;
D、2NH4++5HSO3-+7OH-=2NH3?H2O+5SO32-+5H2O中发生反应5OH-+5HSO3-=5SO32-+5H2O、2NH4++2OH-=2NH3?H2O,亚硫酸氢铵与氢氧化钠物质的量之比为5:7,铵根离子未完全反应,符合反应,故D正确;
故选C.
点评:本题考查离子方程式的书写与判断,难度中等,确定离子反应的先后顺序是关键.
本题难度:简单