1、填空题 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
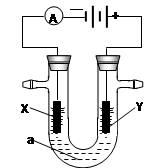
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
检验该电极反应产物的方法是 。
参考答案:.①2H++2e- = H2↑电极表面产生大量气泡,溶液颜色变红
②2Cl- + 2e- = Cl2↑使湿润的淀粉碘化钾试纸变蓝
本题解析:①电解池中X极和电源的负极相连,做阴极,溶液中的氢离子放电生成氢气,电极反应式为2H++2e- = H2↑。由于氢离子放电,破坏了阴极周围水的电离平衡,所以溶液显碱性,则实验中观察到的现象是电极表面产生大量气泡,溶液颜色变红。
②Y电极和电源的正极相连,做阳极,溶液中的氯离子放电,则电极反应式为2Cl- + 2e- = Cl2↑。氯气具有强氧化性,据此可以鉴别,即检验该电极反应产物的方法是使湿润的淀粉碘化钾试纸变蓝。
考点:考查当今饱和食盐水的有关判断
点评:该题是基础性试题的考查,试题紧扣教材基础上,旨在巩固学生的教材,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确电解池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
2、选择题 图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是? (? )
后,使c、d两点短路.下列叙述正确的是? (? )
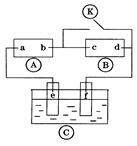
A.a为直流电源的负极
B.d极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生氧化反应
参考答案:D
本题解析:A.接通电路后发现 上的c点显红色.说明在c点H+放电,使c(OH-)的浓度增大,溶液显碱性。因此c电极为阴极,则b为负极,a为正极;错误。B.c与电源的负极连接,c为阴极,d为阳极。在d极发生的反应为2Cl--2e-=Cl2↑.错误。C.由于
上的c点显红色.说明在c点H+放电,使c(OH-)的浓度增大,溶液显碱性。因此c电极为阴极,则b为负极,a为正极;错误。B.c与电源的负极连接,c为阴极,d为阳极。在d极发生的反应为2Cl--2e-=Cl2↑.错误。C.由于 为电镀槽,由于e与电池的正极连接,所以e为阳极,f为阴极。为实现铁上镀锌,阳极e为Zn,阴极f为Fe板。错误。D.e极是阳极,失去电子,发生氧化反应。正确。
为电镀槽,由于e与电池的正极连接,所以e为阳极,f为阴极。为实现铁上镀锌,阳极e为Zn,阴极f为Fe板。错误。D.e极是阳极,失去电子,发生氧化反应。正确。
本题难度:简单
3、选择题 在水中加入等物质的量的Ag+、Ba2+、SO42-、NO3-、Cl-、Na+,用惰性材料作电极进行电解,通电片刻后停止,下列说法不正确的是(?)
A.电解的实质是:阳极:2Cl--2e-====Cl2↑;阴极:Ag+e-====Ag
B.电解的实质是:阳极:4OH--4e-====2H2O+O2↑;阴极:2H++2e-====H2↑
C.要恢复成电解前的溶液可以加水
D.电解产物中氧化产物和还原产物的物质的量之比为1∶2
参考答案:A
本题解析:由原溶液中Ag+与Cl-、Ba2+与SO42-均全部沉淀,故溶液其实是NaNO3溶液,根据放电顺序可知:阳极:4OH--4e-==2H2O+O2↑;阴极:2H++2e-==H2↑,氧化产物氧气和还原产物氢气的物质的量之比为1∶2;相当于电解水,恢复成电解前的溶液可以加水即可;
故答案为A
本题难度:一般
4、填空题 (8分)在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
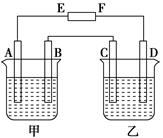
(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
参考答案:(8分)
(1)正 阳 (各1分)
(2)4OH--4e-===2H2O+O2↑(2分) 56(1分)
(3)0.1 (1分)
(4)A HNO3(各1分)
本题解析:(1)根据题意,B极增重1.08g,说明B极有Ag析出,所以B是阴极,A是阳极,则C是阳极,D是阴极,E是正极,F是负极;
(2)A极发生氧化反应,氢氧根离子的放电能量大于硝酸根离子,所以氢氧根离子放电,失去电子生成氧气,则电极反应式为4OH--4e-===2H2O+O2↑;因为析出Ag的质量是1.08g,物质的量是1.08g/108g/ mol=0.01mol,转移电子的物质的量是0.01mol,根据得失电子守恒,生成氧气的物质的量是0.01mol/4,标准状况下的体积是0.01mol/4×22.4L/mol=0.056L=56mL;
(3)乙烧杯是电解氯化铜溶液,两极发生的反应分别是Cu2++2e-==Cu、2Cl--2e-=Cl2↑,当甲中有0.01mol电子转移时,乙析出CuCl2的物质的量是0.005mol,则溶液中剩余CuCl2的物质的量是0.1L×0.15mol/L-0.005mol=0.01mol,所以此时氯化铜溶液的浓度是0.01mol/0.1L=0.1mol/L;
(4)酸使石蕊变红色,甲中A极是氢氧根离子放电,所以氢离子浓度增大,所以A极变红色;继续电解,则甲中析出Ag和氧气,则溶液中剩余氢离子和硝酸根离子,所以最终得到HNO3溶液。
考点:考查电解反应原理的应用,氧化还原反应的计算
本题难度:一般
5、填空题 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是___________。电池工作时,电子流向___________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___________。欲除去Cu2+,最好选用下列试剂中的___________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是______________________。若电解电路中通过2mol电子,MnO2的理论产量为___________。
参考答案:(1)Zn(或锌);正极
(2)Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率;b
(3)2H++2e-=H2↑;87g
本题解析:
本题难度:一般