1、选择题 下列各组元素属于P区的是(? )
A.原子序数为1、2、7的元素?B.O、S、P
C.C.Fe、Ar、Cl?D.Na、Mg、Al
参考答案:B
本题解析:区的名称是来自按构造原理最后填入电子的能级的符号,所以p区位于周期表的第13列到18列,因此正确的答案是B。
本题难度:一般
2、填空题 (10分)下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
?族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| A
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| D
| E
| ?
| G
| I
|
3
| B
| ?
| C
| ?
| F
| ?
| H
| ?
|
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程_________________________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:_______________________________________________________。
参考答案:(1)He,F2,Na? (2)Na,Cl。
(3) HF。? (4)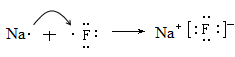
(5) Al(OH)3 + OH-=AlO2- + 2H2O
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知A~I分别是H、Na、Al、C、N、P、F、Cl、Ar。同周期自左向右金属性逐渐减弱,非金属性逐渐增强;同主族自上而下非金属性逐渐减弱,金属性逐渐增强。金属性越强最高价氧化物的水化物的碱性越强,非金属性越强,最高价氧化物的水化物的酸性越强,相应氢化物的稳定性越强。
本题难度:一般
3、选择题 已知Be在周期表中位于Al的左上方,则下列有关Be的说法中错误的是(?)
A.单质Be与酸或碱反应都能放出氢气
B.Be(OH)2为两性氢氧化物
C.Be的氧化物的化学式为Be2O3
D.BeCl2晶体属于分子晶体
参考答案:C
本题解析:Be的氧化物的化学式为BeO,C错。故本题选C。
本题难度:简单
4、选择题 下列叙述错误的是?(?)
A.H2S、H2O、HF的稳定性依次增强
B.Na+、Mg2+、Al3+的氧化性依次减弱
C.H2SiO3、H2CO3、H2SO4的酸性依次增强
D.KOH、NaOH、Mg(OH)2的碱性依次减弱
参考答案:B
本题解析:B项:Na+、Mg2+、Al3+的氧化性依次增强,故错。故选B。
点评:本题考查金属性和非金属性,明确物质的酸性、碱性、阳离子的氧化性、与非金属性、金属性的关系是解答本题的关键,难度不大
本题难度:简单
5、选择题 将酒精和水分离可采用的方法是
A.重结晶
B.蒸馏
C.过滤
D.萃取
参考答案:B
本题解析:酒精和水互溶,应该通过蒸馏的方法分离,答案选B。
本题难度:一般