1、填空题 某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 ?(3分)
(2)沉淀丙中一定含有?(1分),可能含有?(1分)
(3)该溶液中肯定存在的离子有?
(4)气体乙分子的结构式为 ?
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为?;?;?(根据需要,可不填完,也可补充)
参考答案:(1)至少含有CO32—、SO32—中的一种;一定不含有Fe3+ 、Cu2+、Ba2+;一定含有Na+(2)BaCO3;BaSO4(3)Na+、SO32—、AlO2—(4)O=C=O(5)HCO3—+H+=CO2↑+H 2O; Al3++3HCO3—=Al(OH)3↓+3CO2↑
本题解析:(1)通过实验①中,加入过量稀盐酸有气体产生,故溶液中至少含有CO32—、SO32—中的一种,若含有CO32—、SO32—中的一种,则,一定不能含有Fe3+ 、Cu2+、Ba2+。由于溶液中阴阳离子电荷守恒,故一定有阳离子为钠离子。(2)实验②中加入NH4HCO3溶液,得到气体乙,证明原溶液中一定不含有碳酸根,实验①中产生的气体甲为SO2,原溶液中一定含有SO32—。气体乙为二氧化碳。溶液甲中能够与NH4HCO3溶液产生白色沉淀乙只有Al3+。则产生的溶液乙中主要含有碳酸根,钠离子,碳酸氢根,氯离子,铵离子。但不能确定是否含有硫酸根离子。实验③中加入Ba(OH) 2产生的沉淀丙中一定含有BaCO3可能含有BaSO4。产生的气体丙为氨气。(3)通过上述可知,原溶液中一定含有Na+、SO32—、AlO2—三种离子。(4)气体乙为二氧化碳,故其分子结构式为O=C=O(5)甲溶液中含有的主要离子有H+、Al3+故可能发生的离子反应为HCO3—+H+=CO2↑+H 2O;Al3++3HCO3—=Al(OH)3↓+3CO2↑
本题难度:一般
2、选择题 室温下,在由水电离出的c(H+)=1×10-13mol/L的溶液中一定能大量共存的离子组是
A.Fe2+、Na+、NO3-、Cl-
B.Ba2+、Na+、NO3-、Cl-
C.SO42-、HCO3-、NH4+、Na+
D.Mg2+、Na+、Br-、AlO2-
参考答案:B
本题解析:试题分析:室温下,在由水电离出的c(H+)=1×10-13mol/L的溶液可能是酸性也可能是碱性,所以要能够共存的条件是在酸性和碱性条件都能大量共存的才可以。故选B。
考点:离子共存
点评:在此小结一下离子共存的类型:
1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
本题难度:困难
3、选择题 某溶液由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液中的一种或几种混合形成,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示。则下列关于溶液中溶质的判断正确的是(?)
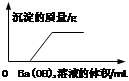
A.肯定没有碳酸钠
B.肯定有硫酸
C.是否含有氯化铜不能确定
D.至少含有硫酸或盐酸中的一种,也可能两种同时含有
参考答案:A
本题解析:某溶液由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液中的一种或几种混合形成,根据盐酸和硫酸分别都可以和碳酸钠溶液反应,所以不能存在硫酸和碳酸钠混合物,也不会是盐酸和碳酸钠溶液的混合物.同时由于碳酸钠和氯化铜能够生成碳酸铜不溶性物质,所以也不存是这两者的混合物。向该混合溶液中滴入氢氧化钡溶液,根据图中可以看出,起始阶段没有沉淀产生沉淀,所以混合物中不含有硫酸根离子,由于消耗了氢氧化钡,所以一定存在盐酸,所以一定不存在碳酸钠.由于盐酸和氢氧化钡反应逐渐消耗,直至盐酸被完全消耗,才产生沉淀,所以该沉淀一定不是硫酸钡或者碳酸钡。由于加入的是氢氧化钡,所以对应的沉淀应该是与氢氧根离子有关,所以生成的沉淀物为氢氧化铜沉淀。所以原混合物应该为盐酸和氯化铜的混合物。
A、根据图可以分析可以看出,混合物中一定不是硫酸,且还为酸性,所以一定不能含有能够与酸反应的碳酸钠。正确。
B、由于加入氢氧化钡后,不是从加入时就产生沉淀,所以一定不含硫酸。错误。
C、由于开始加入氢氧化钡没有沉淀,所以沉淀应该是氢氧根离子有关的氢氧化铜沉淀,所以一定含有氯化铜。错误。
D、根据B分析,一定不存在硫酸,所以也就不存在两者共存的可能.错误。
故选:A。
点评:图表分析时一定要注意从图中归纳出信息提示,如本题中加入氢氧化钡,却在开始阶段没有沉淀,所以硫酸根离子存在,而同时消耗了氢氧化钡,所以该混合物一定能够消耗氢氧根离子,所以混合物为酸性的溶液。
本题难度:一般
4、选择题 20ml 1mol/LCH3COOH溶液跟40ml 0.5mol/LNaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)=c(CH3COO-),c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)>c(CH3COO-)
D.c(Na+)>c(OH-)>c(H+)>c(CH3COO-)
参考答案:A
本题解析:恰好反应生成CH3COONa;醋酸根水解呈碱性;故A正确。
本题难度:困难
5、选择题 在给定的四种溶液中,各离子能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32-、I-
B.含有大量Ba2+的溶液中:K+、OH-、HCO3-、NO3-
C.含有大量H+的无色溶液:Na+、Al3+、NO3-、MnO4-
D.能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32-
参考答案:D
本题解析:
本题难度:一般