1、选择题 在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+
参考答案:C
本题解析:A、Zn首先与Fe3+反应,错误;B、氯气首先与SO32?反应,错误;C、与H+反应的能力OH->AlO2->SO32-,正确;D、在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、Fe3+、NH4+,错误。
本题难度:一般
2、选择题 右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是(?)
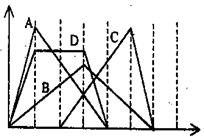
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
参考答案:D
本题解析:根据有关的方程式NaAlO2+HCl+H2O=Al(OH)3+NaCl、Al(OH)3+3HCl=AlCl3+3H2O可知,A正确;向澄清石灰水中通入CO2至过量的方程式是Ca(OH)2+CO2=H2O+CaCO3↓、CaCO3+H2O+CO2=Ca(HCO3)2,所以B正确;同样分析可知,C中氢氧化钠首先和盐酸反应,正确;D中反应的方程式是Ca(OH)2+CO2=H2O+CaCO3↓、2KOH+CO2=K2CO3+H2O、K2CO3+CO2+H2O=2KHCO3、CaCO3+H2O+CO2=Ca(HCO3)2,但D中图像不符合消耗CO2的物质的量,因此D不正确,答案选D。
点评:该题是中等难度的试题,试题贴近高考,难度较大,学生不易得分。该题的关键是准确写出有关反应的化学方程式,然后结合图像灵活分析、判断即可。
本题难度:一般
3、计算题 (9分)固溶体BaInxCo1-xO3-δ是兼具电子导电性与离子导电性的功能材料,Co的氧化数随组成和制备条件而变化,In则保持+3价不变。为测定化合物BaIn0.55Co0.45O3-δ中Co的氧化数,确定化合物中的氧含量,进行了如下分析:称取0.2034 g样品,加入足量KI溶液和适量HCl溶液,与样品反应使其溶解。以淀粉为指示剂,用0.05000 mol/L Na2S2O3标准溶液滴定,消耗10.85 mL。
4-1 写出BaIn0.55Co0.45O3-δ与KI和HCl反应的离子方程式。
4-2 写出滴定反应的离子方程式。
4-3 计算BaIn0.55Co0.45O3-δ样品中Co的氧化数SCo和氧缺陷的量δ(保留到小数点后两位)。
参考答案:(9分)
4-1 BaIn0.55Co0.45O3-δ+(1.45-2δ)I—+(6-2δ)H+=Ba2++0.55In3++0.45Co2++(1.45-2δ)/2I2+(3-δ)H2O
4-2 2S2O32— + I2 = S4O62—+ 2I—
4-3? SCo =" 3.58" δ= 0.37
本题解析:4-3 根据化合物的电中性原则,有
2 + 0.55×3 + 0.45SCo = 2×(3-δ)?(a)
根据反应中的电子得失关系,有
0.45×(SCo-2)×n(样品) = 2n(I2)?(b)
其中:n(样品) =" 0.2034" g/M =0.2034/(275.0-16.00δ)mol
n(I2) = n(S2O32—)/2 = 0.05000M×10.85 mL/2 = 0.2712×10-3mol
解(a)和(b)联立方程
得SCo =" 3.58?" δ= 0.37
本题难度:困难
4、填空题 某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
阴离子
| SO42-、NO3-、Cl-
|
阳离子
| Fe3+、Fe2+、NH4+、Cu2+、Al3+
|
?
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向溶液中加入BaCl2溶液,有白色沉淀生成试回答下列问题。
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是?。
(2)原溶液中含有的阳离子是?。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为?。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为?。
参考答案:(1)溶液变为血红色?(2)Fe2+、Cu2+
(3)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O?(4)160.0g
本题解析:若向原溶液中加入KSCN溶液,无明显变化,这说明溶液中没有铁离子。若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,因此溶液中一定含有氯离子。能产生气泡的只能是NO3-在酸性条件下被还原生成NO,因此一定还含有还原性离子亚铁离子,同时还含有NO3-。③若向溶液中加入BaCl2溶液,有白色沉淀生成,这说明还含有SO42-。由于离子的物质的量均为1mol,则根据溶液的电中性可知,溶液中一定还含有阳离子。由于只能含有5种离子,则根据阴离子的电荷数是4mol可知,另外一种阳离子是铜离子。
(1)在酸性条件下NO3-能把Fe2+氧化生成Fe3+,所以若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是溶液变为血红色。
(2)根据以上分析可知,原溶液中含有的阳离子是Fe2+、Cu2+。
(3)加入盐酸,具有氧化性的NO3-和还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
(4)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,根据题意各离子的物质的量均为1mol可知,m(CuO)=1mol×80g/mol=80g,m(Fe2O3)=0.5mol×160g/mol=80g,所得固体的质量为80g+80g=160.0g。
本题难度:一般
5、选择题 将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
[? ]
A.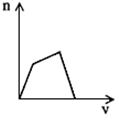 ?
?
B.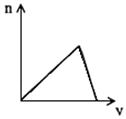 ?
?
C.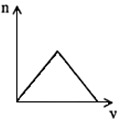 ?
?
D.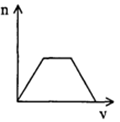
参考答案:D
本题解析:
本题难度:一般