1、推断题 (7分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
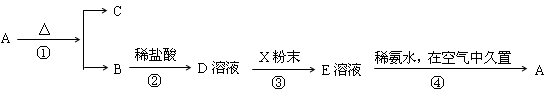
(1)请写出下列物质的化学式:A?、C?。
(2)在①②③④各步反应中属于氧化还原反应的有?(填序号)。
(3)请分别写出反应②的化学方程式和反应③的离子方程式:②?、③?。
参考答案:(1)A:Fe(OH)3? C:H2O
(2)③④
(3)Fe2O3 +6HCl===2FeCl3+3H2O? 2Fe3++Fe===3Fe2+
本题解析:由“E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色物质A”可推知A为氢氧化铁,则推知B为氧化铁,C为水,D为氯化铁,E为氯化亚铁。故
(1)A:Fe(OH)3? C:H2O
(2)①2Fe(OH)3 ?Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
?Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
②Fe2O3 +6HCl=2FeCl3 +3H2O,无化合价的变化,属于非氧化还原反应。
③2FeCl3 +Fe=3FeCl2,Fe的化合价发生改变,属于氧化还原反应。
④4Fe(OH)2 +O2 +2H2O=4Fe(OH)3,Fe的化合价发生改变,属于氧化还原反应。
故答案是③④
(3)根据(2)的答案可知:Fe2O3 +6HCl===2FeCl3+3H2O? 2Fe3++Fe===3Fe2+
点评:熟悉物质的特殊性质作为推断题的突破口。结合题目的信息逐一确定。
本题难度:一般
2、填空题 目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。?
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
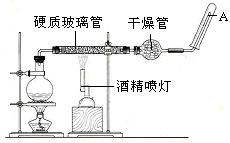
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式:?;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为?
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
?
| ①
| ②
| ③
| ④
|
溶液中的金属离子
| ?
| Fe2+
| ?
| ?
|
残留固体成分
| Fe、Pt
| ?
| Pt
| Pt
|
?
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a =?,b =?,
参考答案:(1)第四周期,第Ⅷ 族? (1分)
(2)3Fe+4H2O(g) Fe3O4+4H2?(2分)
Fe3O4+4H2?(2分)
(3)2Al+Fe2O 3 Al2O3 + 2Fe? (2分)? (答案合理即给分)
Al2O3 + 2Fe? (2分)? (答案合理即给分)
(4)①(2分)
?
①
②
③
④
溶液中的金属离子
Fe2+
Fe2+
Fe2+ Fe3+
Fe3+
残留固体成分
Fe、Pt
Pt
Pt
Pt
②a =0.012,b = 0.02? (2分)
本题解析:(1)Fe在元素周期表中位于第四周期,第Ⅷ 族。
(2)Fe与H2O(g)反应生成Fe3O4和H2,化学方程式为:3Fe+4H2O(g)  Fe3O4+4H2
Fe3O4+4H2
(3)铝和铁的氧化物反应原理来焊接钢轨,化学方程式为:2Al+Fe2O 3 Al2O3 + 2Fe?
Al2O3 + 2Fe?
(4)①因为有Fe剩余,所以溶液含有Fe2+;随着HNO3的增多,Fe全部反应,固体只有Pt;再增加HNO3,部分Fe2+被氧化为Fe3+,溶液含有Fe2+和Fe3+;HNO3达到足量,全部转化为Fe3+。
②溶液中Fe3+与Fe2+和物质的量相等,设Fe2+的物质的量为nmol,则Fe3+也为nmol,根据氧化还原反应电子守恒可知:2n+3n=0.112L÷22.4L/mol×3,得n=0.003mol,Fe2+、Fe3+均为0.003mol,Pt的物质的量分数为x=0.5,则Pt的物质的量为0.006mol,所以a=0.003mol+0.003mol+0.006mol=0.012mol;HNO3反应后转化为Fe(NO3)2、Fe(NO3)3、NO,所以HNO3的物质的量b=0.003mol×2+0.003mol×3+0.112L÷22.4L/mol=0.02mol。
本题难度:一般
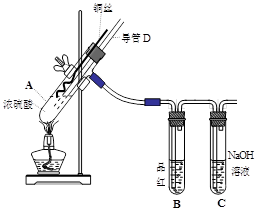
3、简答题 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.
①在试管Ⅰ里加入的试剂是______.
②在试管Ⅱ里加入的试剂是______.
③为了制得Fe(OH)2白色沉淀,正确的操作顺序是______(填下列序号)
A.打开止水夹?B.检验试管Ⅱ出口处排出的H2的纯度
C.夹紧止水夹?D.在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子
④写出此过程中涉及到的化学方程式______.
参考答案:①铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,所以在试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,故答案为:稀H2SO4、铁屑;
②试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,并能产生氢气,当氢气使装置Ι中压强变大,使Ι中的药品硫酸亚铁进入Ⅱ中,与Ⅱ中的药品氢氧化钠反应得到氢氧化亚铁,故答案为:NaOH溶液;
③此题涉及气体生成与检验,所以要检查装置的气密性,检查完毕在装置中加入试剂并塞上塞子,打开止水夹,Ⅰ中生成氢气进入装置Ⅱ,要检验装置Ⅱ中空气是否排尽,要在装置Ⅱ导管口检验气体的纯度,待气体纯净,关闭止水夹,Ⅰ中气压增大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,故答案为:DABC;
④由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;氢氧化钠与硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠,氢氧化钠与硫酸反应生成硫酸钠和水,硫酸与氢氧化亚铁反应生成硫酸亚铁和水,故答案为:FeSO4+2NaOH═Fe(OH)2↓+Na2SO4(必写),H2SO4+2NaOH═Na2SO4+2H2O(或H2SO4+Fe(OH)2═FeSO4+2H2O).
本题解析:
本题难度:一般
4、实验题 (16分)铜与浓硫酸反应,实验装置如图所示。
(1) 装置A中发生反应的化学方程式为:?,反应过程中试管B中的现象是?,试管C的作用是?。
(2) 导管D的下端(虚线段)应位于?(液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;②?。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。
(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为?。
(5)结论:甲中有CuO,还肯定含有的物质是?。
参考答案:33.(16分)(1)Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O (2分)、品红溶液褪色(2分)、吸收多余的SO2,防止污染空气(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2△2CuO (2分)
(5)CuS(2分)
本题解析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端从溶液中提起。
(3) 煅烧的实验用具必须使用耐高温的坩埚,而与坩埚配套使用的还有泥三角、坩埚钳等。
(4)根据题中的判断,该固体甲可能是CuO、Cu2O、CuS、Cu2S,因此用稀盐酸溶解,根据已知的反应,反应得到的固体乙可能是Cu、CuS、Cu2S,对固体乙进行煅烧,因此除了已知的几个煅烧反应外,还可能发生的反应为单质铜的煅烧2Cu+O2△2CuO。
(5) 根据(4)的分析,利用反应的方程式对各种成分煅烧结果进行推断分析,若Cu煅烧,煅烧生成CuO使质量增重;若CuS煅烧,煅烧产生CuO使质量减小;若Cu2S煅烧,煅烧生成CuO是质量不变。因此要满足流程中煅烧前后质量减小,则固体中必须还含有能使煅烧前后质量减小的CuS。
本题难度:一般
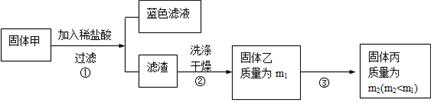
5、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
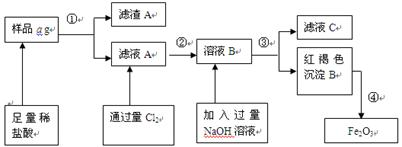
(1)取样品a g,称取时使用的主要仪器名称为_____?_______。
(2)滤液A中溶质主要含有_______??、__? __ _(写化学式);
操作①的名称?,其使用的玻璃仪器有______________________________。
(3)写出由溶液B生成红褐色沉淀B的离子方程式________________________________。
(4) 对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为(用含a、b的式子表示)_____________。
(5)如何验证滤液A中含Fe2+,而不含Fe3+______________________?_____________。
参考答案:(1)托盘天平
(2) FeCl2、AlCl3 ; 过滤 ;?漏斗、烧杯、玻璃棒 。(错写不得分,漏写一个扣1分)
(3) Fe3+ + 3OH - ="=" Fe(OH)3↓
(4) (7b/10a)×100%? {或(70b/a)%}
(5)取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,(2分)
再加氯水(或通氯气),溶液变为血红色。(1分)?(其他合理答案也可以)
本题解析:略
本题难度:一般