1、选择题 下列六种物质不能与CO2反应的是?
①Na2O?②Na2O2?③NaCl溶液?④Na2CO3溶液?⑤NaOH溶液?⑥NaHCO3溶液.
A.①④
B.③⑥
C.②③
D.⑤⑥
参考答案:B
本题解析:分析:二氧化碳是酸性氧化物,利用选项中的各物质的化学性质和二氧化碳的化学性质进行分析判断.
解答:①Na2O能和二氧化碳反应:Na2O+CO2=Na2CO3,故错误;
②Na2O2能和二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2,故错误;
③NaCl溶液不能和二氧化碳反应,故正确;?
④Na2CO3溶液能和二氧化碳反应:Na2CO3+CO2+H2O=2NaHCO3,故错误;
⑤NaOH溶液能和二氧化碳反应:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2=NaHCO3,故错误;
⑥NaHCO3溶液不能和二氧化碳反应,故正确;
故选B.
点评:本题考查了二氧化碳的化学性质,掌握酸性氧化物的性质、强酸制取弱酸的反应原理是解题的关键.
本题难度:困难
2、选择题 下列说法正确的是
A.氮化硅、氧化铝均为高温结构材料
B.汽油、乙烯均为石油分馏产品
C.明矾、漂白粉均为自来水消毒剂
D.光导纤维、涤纶均为合成高分子材料
参考答案:A
本题解析:分析:A.氮化硅、氧化铝熔点很高,可以做高温结构材料;
B.乙烯是石油裂解的产品;
C.明矾可以净水,但不能杀菌消毒;
D.光导纤维主要成分是二氧化硅,不是高分子材料.
解答:A.氮化硅、氧化铝熔点很高,可以做高温结构材料,故A正确;
B.汽油是石油分馏产品,乙烯是石油裂解的产品,故B错误;
C.明矾水解生成氢氧化铝胶体,吸附悬浮物质,起净水作用,但不能杀菌消毒,漂白粉具有强氧化性,可以作自来水消毒剂,故C错误;
D.光导纤维主要成分是二氧化硅,不是高分子材料,故D错误;
故选A.
点评:本题考查石油炼制、新型材料、铝及氯的重要化合物性质与用途等,比较基础,旨在考查学生对基础知识的全面掌握.
本题难度:困难
3、选择题 还原某二价金属的氧化物4克,需0.2mol电子,则该金属元素的相对原子质量为
A.24
B.40
C.56
D.64
参考答案:A
本题解析:分析:先根据金属氧化物和转移电子的关系式计算氧化物的物质的量,再根据M= 计算氧化物的摩尔质量,摩尔质量在数值上等于其相对分子质量,从而求出金属元素的相对原子质量.
计算氧化物的摩尔质量,摩尔质量在数值上等于其相对分子质量,从而求出金属元素的相对原子质量.
解答:设金属元素为R,金属氧化物的物质的量为X.
RO→R转移电子
1mol 2mol
X? 0.2mol
X=0.1mol,
金属氧化物的摩尔质量=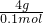 =40g/mol,金属氧化物的相对分子质量为40,所以金属原子的相对原子质量为40-16=24,故选A.
=40g/mol,金属氧化物的相对分子质量为40,所以金属原子的相对原子质量为40-16=24,故选A.
点评:本题考查了氧化还原反应的有关计算,难度不大,能明确金属氧化物和转移电子的关系、摩尔质量和质量物质的量的关系、摩尔质量和相对分子质量的关系即可分析解答本题.
本题难度:一般
4、选择题 已知:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,有关该反应的下列说法中正确的是
A.氧化剂和还原剂的物质的量之比为15:11
B.上述反应中转移电子的总数为15
C.1molCuSO4参加反应时,转移电子2mol
D.Cu3P既是氧化产物又是还原产物
参考答案:C
本题解析:分析:A、根据得失电子判断氧化剂和还原剂,从而确定其比值;
B、根据元素化合价的变化确定转移电子总数;
C、根据硫酸铜和转移电子之间的关系式确定转移电子数;
D、氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物.
解答:A、该反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中部分磷作氧化剂,部分磷作还原剂,硫酸铜是氧化剂,5P(氧化剂)+6P(还原剂)+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,所以氧化剂和还原剂的物质的量之比=(15+5):6=10:3,故A错误;
B、以还原剂P计算,该反应中转移电子数=6×(5-0)=30,故B错误;
C、11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4转移电子
?15mol? 30mol
? 1mol?2mol
所以当1molCuSO4参加反应时,转移电子2mol,故C正确;
D、该反应中磷化亚铜是还原产物不是氧化产物,故D错误;
故选C.
点评:本题考查了氧化剂和还原剂的判断、电子转移等知识点,注意该反应中P既是氧化剂又是还原剂,会根据元素化合价的变化判断氧化剂、还原剂和氧化产物、还原产物,难度不大.
本题难度:简单
5、选择题 制备Al(OH)3,最适宜的药品是
A.Al2(SO4)3和NaOH
B.AlCl3和NaOH
C.Al2(SO4)3和氨水
D.Al2(SO4)3和Na2CO3
参考答案:C
本题解析:A、B中生成的Al(OH)3会被过量NaOH溶解,无法控制量,D中反应产生大量CO2气体。
本题难度:困难