1、选择题 下表中给出几种氯化物的熔点和沸点
?
| NaCl
| MgCl2
| AlCl3
| SiCl4
| 单质B
|
熔点(℃)
| 801
| 714
| 190
| —70
| 2300
|
沸点(℃)
| 1413
| 1412
| 180
| 57.57
| 2500
|
下列说法错误的是(?)
A.SiCl4分是子晶体? B.单质B可能是原子晶体
C.AlCl3在加热时能升华? D.NaCl比MgCl2更容易熔化
参考答案:D
本题解析:A项:SiCl4的熔沸点特别低,属于分子晶体;B项:,原子晶体的溶沸点一般很高,故B项正确;C项:AlCl3的熔点比沸点高,故它可以升华;D项:由熔点可知MgCl2比NaCl更容易熔化
本题难度:一般
2、选择题 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.下列关系中正确的是( )
A.2E1=E2
B.2E1>E2
C.2E1<E2
D.E1=E2
参考答案:B
本题解析:
本题难度:简单
3、选择题 在一定条件下,可发生反应:RO3n- +F2?+2OH-==RO4-+2F-+H2O。则RO3n-中R元素的化合价是?
[? ]
A.+4 ?
B.+5 ?
C.+6 ?
D.+7
参考答案:B
本题解析:
本题难度:简单
4、填空题 我国已启动的“西气东输”工程是为了改善我国东部的能源结构,其中的“气”是指天然气,其主要成分的分子的电子式为______,结构式为______;分子里各原子的空间分布呈______结构.
参考答案:因甲烷中碳原子要形成4对共用电子对,氢原子要形成1对共用电子对,甲烷的电子式为
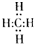
,将电子式中的每一对共用电子对用一根短线来表示,其他电子省略,得到结构式为:
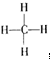
,因甲烷分子中碳原子处于正四面体的中心,4个H原子处处于正四面体的四个顶角,所以分子里各原子的空间分布呈正四面体.
故答案为:
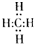
;

;正四面体.
本题解析:
本题难度:一般
5、填空题 (1)甲醛易溶于水的原因是_______________________________________。
(2)沸点:甲醇_______甲醛(填“>”或“<”);原因:_________________________。
(3)为了减缓温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2 。若有2mol CH4生成,则有?mol σ键和?mol π键断裂。
(4)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为____________________________(填序号)。
参考答案:.(9分)(1)甲醛与水分子间形成氢键(2分)
(2)>(1分);甲醇分子间有氢键(2分)
(3)12 (1分)? 4(1分)?(4)①⑤③②④⑥?(2分)
本题解析:(1)由于甲醛与水分子间形成氢键,所以甲醛是易溶于水的。
(2)由于甲醇分子间有氢键,所以甲醇的沸点高于甲醛的沸点。
(3)如果有2mol CH4生成,则必然有2molCO2和8mol氢气参加反应。由于单键都是σ键,二双键是由1个σ键和1个π键,因此在反应中有12mol σ键和4mol π键断裂。
(4)CO2、CS2是分子晶体,但二硫化碳的分子间作用力强于CO2的分子间作用力,所以熔点是二硫化碳的高于CO2的;氯化钠是离子晶体,金属钠是金属晶体,熔点低于氯化钠的。硅和金刚石都是原子晶体,但由于金刚石中共价键强于硅中的共价键,所以金刚石的熔点最高,则6种晶体的熔点从低到高的顺序为①⑤③②④⑥。
点评:该题是基础性试题的考查,也是高考中的常见题型。试题紧扣教材,旨在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,增强学生的学习自信心。
本题难度:一般