1、填空题 下图是元素周期表的一部分,各元素在周期表中的位置如下,据此回答下列问题

(1)下列各组元素中最容易形成离子键的是___________,最容易形成共价键的是_____________
A.c和h B.b和k C.e和j D.e和i
(2)下列由a~k形成的各分子中,所有原子都满足最外层电子数8电子结构的是____________
A.ga3 B.ak C.hk3 D.ek4
(3)请用化学方程式解释下列现象
①玻璃容器不能盛放j的氢化物的水溶液:______________________
②b的氧化物对应的水化物溶液不能贮存在d制品中:______________________
参考答案:(1)B;D
(2)CD
(3)①4HF+SiO2==SiF4↑+2H2O;②2Al+2NaOH+2H2O==2NaAlO2+3H2↑
本题解析:
本题难度:一般
2、填空题 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H3BO3的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为________元酸,[B(OH)4]-含有的化学键类型为________。

参考答案:(1)平面三角形 sp2
(2)BP 原子晶体
(3)①6 3 ②一 共价键、配位键
本题解析:(1)BF3分子中,B原子形成了3个σ键,不含孤电子对,故杂化轨道数为3,杂化方式为sp2杂化,BF3分子立体构型为平面三角形。(2)一个晶胞中含有B原子的个数为8×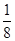 +6×
+6×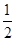 =4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H3BO3的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH)3·H2O可电离出1 mol H+,故硼酸为一元酸;[B(OH)4]-离子中B原子有一个空的2p轨道,而OH-含有孤电子对,两者之间可以形成配位键。
=4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H3BO3的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH)3·H2O可电离出1 mol H+,故硼酸为一元酸;[B(OH)4]-离子中B原子有一个空的2p轨道,而OH-含有孤电子对,两者之间可以形成配位键。
本题难度:一般
3、选择题 下列过程中,共价键被破坏的是
[? ]
A.碘升华
B.溴蒸气被木炭吸附
C.酒精溶于水
D.HCl气体溶于水
参考答案:D
本题解析:
本题难度:简单
4、填空题 如表是元素周期表的一部分,回答下列问题:

(1)写出①---(12)号元素的元素符号①______?②______?③______?④______
⑤______?⑥______?⑦______?⑧______?⑨______?⑩______?(11)______?(12)______
(2)写出①、③两种元素形成的化合物有两种,化学式:______,______.
(3)写出①元素最高价氧化物的电子式和结构式______,______.
(4)这些元素的最高价氧化物的对应水化物中______酸性最强;______碱性最强;能形成两性氢氧化物的元素是______,形成两性氢氧化物化学式______.
参考答案:(1)根据元素所在周期表中的位置不难判断①---(12)号元素依次为:C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Ar,故答案为:C;N;O;F;Na;Mg;Al;Si;P;S;Cl;Ar;
(2)①为C元素,化合价有+2价和+4价,③为O元素,所以对应的化合物有CO和CO2,故答案为:CO;CO2;
(3)C元素最高价氧化物是CO2,为共价化合物,电子式为
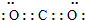
,空间结构为直线形分子,C和O原子之间存在C=O键,结构式为O=C=O,
故答案为:
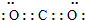
;O=C=O;
(4)周期表中,同周期元素从左到右元素的非金属性逐渐增强,金属性逐渐减弱,同主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,则非金属性最强的元素为F,但F无正价,对应最高价氧化物的对应水化物酸性最强的为
HClO4,金属性最强的元素为Na元素,最高价氧化物的对应水化物NaOH碱性最强,能形成两性氢氧化物的元素是Al元素,对应的氢氧化物为Al(OH)3,
故答案为:HClO4;NaOH;Al;Al(OH)3.
本题解析:
本题难度:简单
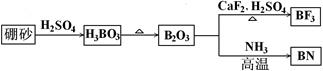
5、填空题 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是?
?
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4—的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
参考答案:(1)B2O3+3CaF2+3H2SO4D?2BF3+3CaSO4+3H2O?B2O3+2NH3高温2BN+3H2O
(2) 120°? sp2?正四面体?(3)共价键(极性共价键)?分子间力
(4)4? 4?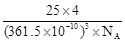
本题解析:(1)由B2O3制备BF3、BN的化学方程式依次是B2O3+3CaF2+3H2SO4D?2BF3+3CaSO4+3H2O?、?B2O3+2NH3高温2BN+3H2O;(2)在BF3分子中,中B原子为sp2杂化,其空间构型为平面三角形,B位于三角形的中央,故其键角为120°;BF3和过量NaF作用可生成NaBF4,此时B为sp3杂化,故BF4—的立体结构为正四面体;(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,金刚石为正四面体,硬度与金刚石相当,则该晶体为原子晶体,晶胞边长为361.5pm,所以立方氮化硼晶胞中含有4个氮原子,含有4个硼原子,立方氮化硼晶胞中含有4BN,B的相对原子质量为11,而N的相对原子质量为14,所以立方氮化硼的密度是: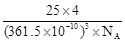 .
.
点评:本题考查了化学反应方程式的书写、杂化理论、化学键、晶胞的计算,该题的综合性好,本题难度中等。
本题难度:一般