|
高中化学知识点大全《物质的组成》高频试题预测(2019年最新版)(六)
2019-05-30 05:40:53
【 大 中 小】
|
1、选择题 A、B、C都是短周期元素,原子序数依次增大。B是地壳中含量最多的元素;化合物AxBy有多种形式,有的可以导致酸雨;化合物CmBn也有不同形式,其中m、n可以是2:1或1:1。下列判断正确的是:?
A、原子半径由大到小的顺序是:C>B>A
B、AxBy中A的化合价不可能为+1价
C、C与B形成的化合物溶于水都能得到单质B
D、A、B两元素的气态氢化物可以相互反应
参考答案:D
本题解析:略
本题难度:一般
2、填空题 根据X、Y、Z、W四种常见元素的下列信息,回答有关问题:
信息1:上述四种元素均为短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息1,X一定不是________(填序号);
A.氢
B.碳
C.氧
D.硫
| 信息2:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素________(填“是”或“否”);
信息3:向上述四种元素的单质组成的混合物中加入足量稀盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)生成白色沉淀物的化学式为_________________________________________;
信息4:向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入足量的稀盐酸,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的化学式为___________________________________________。
参考答案:(1)A? (2)是? (3)Mg(OH)2? (4)H2SiO3
本题解析:(1)由原子核外最外层电子均不少于2,则明显氢不符。
(2)由有一种氧化物既能溶于稀H2SO4,还能溶于浓NaOH溶液故有Al元素。
(3)单质固体混合物加入盐酸部分溶解,说明是金属单质,向滤液中加入过量NaOH,得到白色沉淀是Mg(OH)2。
(4)向加NaOH溶液后的滤液中加入足量HCl,只能是H2SiO3沉淀。
本题难度:一般
3、填空题 (15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为?。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是?(填序号)。
a.Cl2、Br2、I2的熔点? b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性? d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液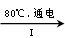 NaClO3溶液 NaClO3溶液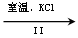 KClO3晶体 KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□?。
②Ⅱ中转化的基本反应类型是?,该反应过程能析出KClO3晶体而无其它晶体析出的原因是?。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
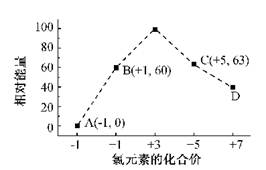
①D是?(填离子符号)。
②B→A+C反应的热化学方程式为?(用离子符号表示)。
参考答案:
⑴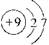 ?⑵b、c ?⑵b、c
⑶①1NaCl+3H2O=1NaClO3+3H2↑
②复分解反应?室温下,氯酸钾在水中的溶解度明显小于其它晶体
⑷①ClO4-?
②3ClO-(aq)=ClO3-?(aq)+2Cl-(aq),ΔH=-117KJ·mol-1
本题解析:⑴与氯元素同族的短周期元素为氟元素,其原子结构示意图为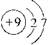 。 。
⑵非金属单质的氧化性、非金属元素的氢化物的稳定性能作为判断非金属性递变规律的判断依据,而非金属单质的熔点(物理性质)、非金属元素的氢化物的酸性(没有相似的递变规律)不能作为判断非金属性递变规律的判断依据。
⑶①首先分析80 ℃下电解NaCl溶液在阳极产生NaClO3,在阴极产生H2,然后根据氧化还原反应化合价升降法将其配平。
②Ⅱ中所发生的反应为:NaClO3+KCl=KClO3↓+NaCl,属于复分解反应;由于室温下,氯酸钾在水中的溶解度明显小于其它晶体,故该反应过程能析出KClO3晶体而无其它晶体析出。
⑷①据图知D对应的化合价为+7,则其含氯的离子为ClO4-?。
②据图知A为Cl-,B为ClO-,C为ClO3-?,则B→A+C反应的化学方程式(并标出状态)为:3ClO-(aq)=ClO3-?(aq)+2Cl-(aq),反应放出热量:60×3-63×1-0×2=117KJ/mol,故其反应热ΔH=-117KJ/mol,综上便可写出完整的热化学方程式。
本题难度:一般
4、选择题 据报道,元素钬有一种放射性核素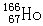 可有效治疗肝癌。该核素原子核内的中子数为 可有效治疗肝癌。该核素原子核内的中子数为
A.67
B.99
C.166
D.233
参考答案:B
本题解析:中子数+质子数=质量数,所以该原子核内中子数=166-67=99,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,该题的关键是记住中子数、质子数和质量数的关系,然后灵活运用即可,学生很易得分。
本题难度:简单
5、选择题 某元素X的气态氢化物的化学式为H2X,则X的最高氧化物的水化物的化学式为(?)
A.H2XO3
B.HXO3
C.H3XO4
D.H2XO4
参考答案:D
本题解析:H2X中X元素的化合价为—2,故其最高价为+6,最高氧化物的水化物的化学式H2XO4
本题难度:一般
|