1、选择题 25°C时,弱酸的电离平衡常数如下表:
弱酸
| CH3COOH
| HCN
| H2CO3
|
Ka
| 1.8×10-5
| 4.9×10-10
| K1:4.3×10-7
K2:5.6×10-11
|
?
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN与b mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力增大
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
参考答案:D
本题解析:A项,酸越弱,其对应的盐的水解程度越大,溶液的pH越大,结合表格的数据可知pH大小关系为pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故不正确;B项,若a=b,则两者恰好完全反应生成NaCN溶液,因CN-水解也能使溶液中的c(Na+)>c(CN-),故不正确。根据冰醋酸加水导电性曲线,C项错误,D项符合电荷守恒,正确。
本题难度:一般
2、选择题 下列各选项中所述的两个量,前者一定大于后者的是
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
B.pH=1的CH3COOH溶液和盐酸的物质的量浓度
C.pH=12的氨水和NaOH溶液的导电能力
D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
参考答案:B
本题解析:A错,虽两者溶质的物质的量相等,但对于弱电解质醋酸来说,越稀越易电离,电离程度越大,即,1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数前者一定小于后者;B正确;C错,电解质溶液的导电性强弱与溶液中自由移动的离子浓度有关,浓度越大,溶液的导电性越强;D错,pH相同的等体积的盐酸和醋酸溶液,醋酸的物质的量更多,与足量锌粒反应产生的气体体积更多;
本题难度:一般
3、填空题 北京奥运会“祥云”火炬的燃料是丙烷(C3H8),亚特兰大奥运会火炬的燃料是丙烯(C3H6)。 (1)丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g)? ΔH1=156.6?kJ/mol
CH3CH=CH2(g)―→CH4(g)+HC≡CH(g) ΔH2=32.4?kJ/mol
则相同条件下,反应C3H8(g)―→CH3CH=CH2(g)+H2(g)的ΔH=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为_____________;放电时,CO32-移向电池的________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5?mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3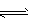 HCO3-+H+?的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
HCO3-+H+?的平衡常数K1=________。(已知:10-5.60=2.5×10-6)
(4)常温下,溶液中c(H2CO3)________c(CO32-)(填“>”“=”或“<”),原因是___________________________(用离子方程式和必要的文字说明)。
参考答案:(1)124.2
(2)C3H8+5O2===3CO2+4H2O ;负
(3)4.2×10-7?mol/L
(4)> ;HCO3-+H2O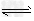 CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3-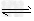 CO32-+H+),HCO3-+H2O?
CO32-+H+),HCO3-+H2O?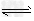 H2CO3
H2CO3
本题解析:
本题难度:一般
4、填空题 化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡. NH3+H2O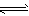 NH3·H2O
NH3·H2O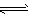 NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度__________, NH4+的浓度_____。
(2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有 ___________、___________、___________。
(3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 __________。
参考答案:(1)右;减小;增大?
(2)右;OH-;NH3·H2O;NH3
(3)左;NaOH固体溶解,溶液中产生气泡
本题解析:
本题难度:一般
5、填空题 有pH均为2的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 (用“>、<、=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则其关系是 ;反应过程中放出H2的速率依次为b1、b2、b3,则其关系是
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是 。
参考答案:(1)C3>C1>C2 (2)a1=a2=a3 b1=b2<b3 (3)V1=V2>V3
本题解析:略
本题难度:一般