1、选择题 下列各组中的离子,能在溶液中大量共存的是
A.H+、Na+、HCO3-、F-
B.Ba2+、NH4+、CO32-、Cl一
C.K+、Mg2+、SO42-、OH-
D.Ag+、Al3+、NO3-、H+
参考答案:D
本题解析:H+与HCO3-反应,不能共存,A错误;Ba2+与CO32-反应不能共存,B错误;Mg2+与OH-反应不能共存,C错误;所以答案选D。
本题难度:简单
2、填空题 某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为0.1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1)若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是:?;
(2)写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:________________________________________________________________________;
(3)经分析,该溶液仅含的4种离子是:______________________________________;
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变,②所含离子的物质的量均为0.1mol,则③是__________________________________________;
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为______g
参考答案:(1)有气泡产生,溶液呈红色?;
(2)3 Fe2+ + NO3- + 4 H+ =" 3" Fe3+ + NO↑ + 2 H2O ;
(3)Fe2+、SO42-、NO3-、Na+;
(4)溶液中离子的电荷守恒 ;
(5)8
本题解析:由题意“若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变”可知含有Fe2+、SO42-、NO3-;而且由于发生反应3 Fe2+ + NO3- + 4 H+ =" 3" Fe3+ + NO↑ + 2 H2O ;而产生气体,
又因为含有的离子的物质的量相等,由电荷守恒确定含有Na+;Fe2+的物质的量为0.1mol,“若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,”最后得到的固体为Fe2O3物质的量为0.05mol,质量为0.05mol×160g/mol=8g。
本题难度:一般
3、选择题 下列有关离子浓度的关系正确的是
A. 0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.0.1mol/L NaHA溶液的pH="3:?" c(HA一) >c(H+) >c(H2A)>c(A2-)
D.新制氯水中c(Cl2)=2[c(ClO—)+c(Cl—)+c(HClO)]
参考答案:B
本题解析:略
本题难度:简单
4、选择题 室温下,下列各组离子在指定溶液中一定能大量共存的是
A.饱和氯水中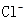 、
、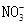 、
、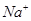 、
、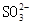
B.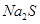 溶液中
溶液中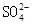 、
、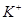 、
、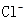 、
、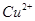
C.pH=13的溶液中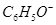 、
、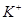 、
、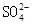 、
、
D.由水电离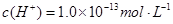 溶液中
溶液中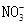 、
、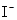 、
、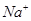 、
、
参考答案:C
本题解析:A错,氯水具有强氧化性,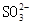 不能共存;B错,
不能共存;B错,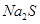 能与
能与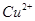 反应生成硫化铜;C正确,pH=13的溶液为碱性溶液,它们可共存;D错,由水电离
反应生成硫化铜;C正确,pH=13的溶液为碱性溶液,它们可共存;D错,由水电离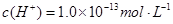 溶液可以是酸性溶液,也可以是碱性溶液,在酸性溶液中,
溶液可以是酸性溶液,也可以是碱性溶液,在酸性溶液中,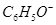 不能共存会生成苯酚;
不能共存会生成苯酚;
本题难度:一般
5、填空题 (1)0.1mol/L Na2CO3溶液呈?(填“酸性”、“碱性”或“中性”),其原因是?(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式?;
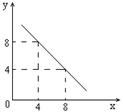
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为?;该温度下0.01 mol/L NaOH溶液的pH为?。
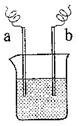
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu? b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有?;(填序号)
A.Cu2+
B.Na+
C.Fe2+
D.Ag+
 Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到?mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到?mol·L一1。