1、选择题 下列表示对应化学反应的离子方程式正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.向Ca(ClO)2溶液中通入过量的 SO2:C1O- + SO2 + H2O =" HClO" + HSO3-
D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2 = 2Fe3++2OH-
参考答案:A
本题解析:A、NaHSO4溶液与Ba(OH)2溶液反应至中性,H+与OH?恰好完全反应,NaHSO4与Ba(OH)2物质的量之比为2:1,离子方程式正确;B、Ca(HCO3)2溶液中加入少量NaOH溶液,HCO3?过量,HCO3?与OH?的物质的量之比为1:1,离子方程式错误;C、HClO具有强氧化性,氧化S元素,不可能生成HSO3?,离子方程式错误;D、酸性溶液中发生的离子反应,不可能生成OH?,离子方程式错误。
本题难度:一般
2、选择题 下列表示对应化学反应的离子方程式正确的是
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+ H2O

C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2: 3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
参考答案:D
本题解析:A项应为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;B项应为2CH3COOH+CaCO3=Ca2++ CO2↑+ H2O+2CH3COO-;C项应为HCO3-+H+=H2O+CO2↑。
Mn2++Cl2↑+2H2O;B项应为2CH3COOH+CaCO3=Ca2++ CO2↑+ H2O+2CH3COO-;C项应为HCO3-+H+=H2O+CO2↑。
本题难度:一般
3、选择题 烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )
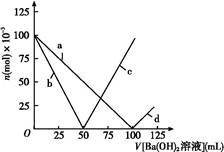
A.曲线a表示Ba2+的物质的量的变化
B.曲线c表示OH-的物质的量的变化
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O
BaSO4↓+H2O
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O
H2O
参考答案:B
本题解析:起始n(NaHSO4)="0.1" mol,即n(Na+)="0.1" mol[反应前后n(Na+)不变,所以曲线不对应Na+],n(H+)="0.1" mol,n(SO42—)="0.1" mol,加入Ba(OH)2溶液后,SO42—、H+要减少,加入Ba(OH)2溶液50 mL时,即n[Ba(OH)2]="0.05" mol,此时H+中和完,所以曲线b表示H+的变化,SO42—反应一半,当加入Ba(OH)2溶液大于50 mL时,OH-开始增多,所以曲线c表示OH-的变化,当加入Ba(OH)2溶液100 mL时,SO42—沉淀完,所以曲线a表示SO42—的变化,加入Ba(OH)2溶液大于100 mL时,Ba2+开始增多,所以曲线d表示Ba2+的变化,加入Ba(OH)2溶液50 mL 时,反应的H+与SO42—的物质的量之比为2∶1,所以离子方程式为:Ba2++2OH-+2H++SO42— 2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42—
2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42— BaSO4↓。
BaSO4↓。
本题难度:一般
4、选择题 下列离子方程式,正确的是
A.氢氧化铁与盐酸反应:H++OH-=H2O
B.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O
C.铁与H2SO4反应:Fe+2H+=Fe3++H2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO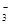 +Ca2++OH-= CaCO3↓+H2O
+Ca2++OH-= CaCO3↓+H2O
参考答案:D
本题解析:氢氧化铁与盐酸反应反应生成氯化铁和水,离子反应为Fe(OH)3+3H+═Fe3++3H2O,故A错误;CaCO3溶于稀盐酸中反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;铁与H2SO4反应的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;Ca(HCO3)2溶液与少量NaOH溶液反应:HCO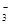 +Ca2++OH-= CaCO3↓+H2O,故D正确。
+Ca2++OH-= CaCO3↓+H2O,故D正确。
本题难度:一般
5、选择题 下列离子方程式正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑
B.氧化镁与盐酸混合:MgO+2H+═Mg2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag
D.大理石溶于醋酸的反应:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O
参考答案:A、铜与稀硫酸不反应,故A错误;
B、氧化镁为碱性氧化物,与酸反应生成盐和水,氧化镁不溶于水,
离子方程式中应写成化学式,反应为MgO+2H+═Mg2++2H2O,故B正确;
C、电荷不守恒,正确的离子方程式为Cu+2Ag+=2Ag+Cu2+,故C错误;
D、大理石的主要成分为碳酸钙,不溶于水,离子方程式中应写成化学式,
正确的离子方程式为CaCO3+2CH3COOH═2CH3COO-+CO2↑+Ca2++H2O,故D错误.
故选B.
本题解析:
本题难度:一般