1、选择题 常温时,以下4种溶液pH最大的是
[? ]
A.0.01mol·L-1氨水溶液
B.0.02mol·L-1氨水与0.02mol·L-1盐酸溶液等体积混合液
C.0.03mol·L-1氨水与0.01mol·L-1盐酸溶液等体积混合液
D.pH =2的盐酸与pH =12的Ba(OH)2溶液等体积混合液
参考答案:A
本题解析:
本题难度:一般
2、选择题 常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
[? ]
A.某溶液中由水电离出的c(OH-)=1×10-a mol/L,当a>7时,该溶液的pH一定为14-a
B.将0.1 mol/L的某一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+)
C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.常温下,NaHSO3溶液的pH<7,溶液中c(SO42-)<c(H2SO3)
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种蜡酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中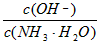 增大
增大
参考答案:C
本题解析:
本题难度:一般
4、简答题 25℃时,如果取0.1mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):______;
(2)混合溶液中由水电离出的c(H+)______(填“<”“>”“=”)0.1mol?L-1?NaOH溶液中由水电离出的c(H+);
(3)求出混合液中下列算式的精确计算结果:c(Na+)-c(A-)=______mol?L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7?(填“<”“>”“=”);
(5)将相同温度下相同浓度的五种溶液:①(NH4)2CO3;②NH3?H2O;③(NH4)2SO4;④NH4Cl;⑤CH3COONH4 按c(NH4+)由大到小的顺序排列______填序号).
参考答案:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O=HA+OH-,
故答案为:A-+H2O?HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol?L-1NaOH溶液中由水电离出的c(H+),
故答案为:>;
(3)溶液中存在电荷守恒,即:c?(Na+)+c(H+)=c(A-)+c(OH-),
则c?(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,
故答案为:9.9×10-7;
(4)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7,
故答案为:>;
(5)①③④⑤相比,由于①⑤中NH4+水解得到促进,水解程度大于③④,且①>⑤中c(NH4+);
③中(NH4)2SO4物质的量浓度与④相比,当二者浓度相等时,③中c(NH4+)接近④的2倍,
NH3?H2O,溶液中c(NH4+)小于铵盐的c(NH4+),应最小,由于水解程度一般较小,则①>④,
按c(NH4+)由大到小的顺序排列为③①④⑤②.
故答案为:③①④⑤②.
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是?
[? ]
A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<?c(NH4Cl)
B.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3
C.0.2?mol·L-1?HCl溶液与等体积0.05?mol·L-1?Ba(OH)2溶液混合后,溶液的pH=1
D.已知难溶物FeS的Ksp?=?8.1×10-17,FeS饱和溶液中c(H+)2·c(S2-)?=?1.0×10-22,为使溶液里c(Fe2+)达到了1mol/L,应调节溶液中的c(H+)为1.11×10-3mol/L
参考答案:D
本题解析:
本题难度:一般