1、选择题 某混合气体可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体的体积都没有变化。再通过足量的Na2O2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2,CO和HCl中至少有一种
D.一定有N2和HCl,没有CO
参考答案:C
本题解析:因为反应到最后还有剩余的气体,因此一定含氮气。再通过足量的Na2O2固体,气体体积减小,证明在这之前产生了二氧化碳。最后通过灼热的铜网,经充分反应后气体体积又减小,表明一定含有二氧化碳,二氧化碳跟过氧化钠产生的氧气与铜反应了。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体的体积都没有变化,有三种情况:一是氮气、氯化氢,氯化氢跟碳酸氢钠反应生成与氯化氢体积相等的二氧化碳,二是氮气、一氧化碳, 一氧化碳与灼热的氧化铜反应生成等体积的二氧化碳,三是氮气、一氧化碳、氯化氢三种混和气体,综上所述,选C。
本题难度:一般
2、选择题 一辆载有约35吨液氯的槽罐车与一辆货车相撞,导致槽罐车中液氯大面积泄漏,造成多人伤亡。下列处理方法和过程合理的是
A.将人群转移到地势较低的地方,等待营救
B.将槽罐车推入附近的水塘中,撒上石灰
C.用高压水枪向空中喷洒大量浓氨水溶液
D.被转移人群可戴上用NaOH处理过的口罩
参考答案:B
本题解析:略
本题难度:一般
3、实验题 某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。

(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:____________________________________。
参考答案:(1)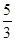
(2)B中长颈漏斗中液面上升,形成液柱
(3)无水氯化钙(硅胶、P2O5)、干燥的有色布条
(4)打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘
(5)Cl2+2NaOH=NaCl+NaClO+H2O
(6)SO32-+Cl2+H2O=SO42-+2Cl-+2H+、SO32-+2H+=SO2↑+H2O
本题解析:(1)KClO3与浓盐酸发生反应:KClO3+6HCl=3Cl2+KCl+3H2O,由氧化还原反应可知,生成3 mol Cl2,转移5 mol电子,因此当产生1 mol Cl2时,转移电子的物质的量为5/3 mol。(2)若装置C发生堵塞,则B内压强变大,导致B中长颈漏斗中液面上升,形成液柱。(3)为做对比,看干燥的氯气是否具有漂白性,Ⅱ处应放吸水剂,Ⅲ处放干燥的有色布条。
点拨:本题考查物质的制备与性质验证实验等,考查考生的实验能力。难度中等。
本题难度:一般
4、实验题 实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ
验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器。
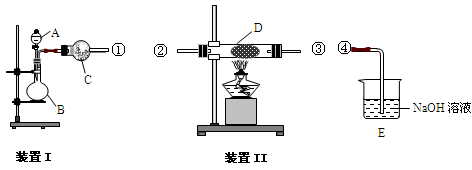
请回答下列问题:
(1)①仪器A的名称是?,仪器B中应加入的固体药品 ?(填化学式);
②实验中观察到D内红棕色气体的化学式为?,证明氨气具有?性;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为?;
②此时仪器C中改为盛装P2O5 的作用是?。
参考答案:(1)①分液漏斗; Na2O2 ;?②NO2?; 还原性
(2)①Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑②干燥SO2气体
本题解析:(1)①根据题意,装置Ⅰ中产生的是氨气和氧气,所以可以加入Na2O2固体;②含氮的化合物只有NO2为红棕色气体,氨气被氧化为二氧化氮,所以氨气表现了还原性?;(2)①根据强酸制弱酸的原理,反应为:Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑②P2O5通常用作酸性干燥剂。
本题难度:一般
5、选择题 常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
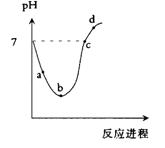
A.a点所示的溶液中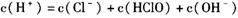
B.b点所示的溶液中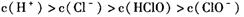
C.c点所示的溶液中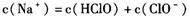
D.d点所示的溶液中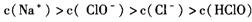
参考答案:B
本题解析:考查溶液中离子浓度大小比较。A选项错误,a点溶液是不饱和的氯水,根据电荷守恒,式中C(HClO)错误,应改为C(ClO-);B选项正确,b点是饱和氯水,其中反应生成盐酸与次氯酸,盐酸是强电解质,次氯酸是弱电解质,所以氢离子浓度最大,B选项正确;C选项错误,c点中性溶液,根据电荷守恒可得关系c(Na+)=c(Cl-)+c(ClO-),由于c点次氯酸参与反应,很明显c(ClO-)与c(Cl-)不等,所以C选项错误;D点是生成了氯化钠与次氯酸钠混合液,c(ClO-)不可能比c(Cl-)大。答案选B。
本题难度:一般