1、填空题 卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡?
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小?
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:

写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应: 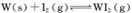 。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
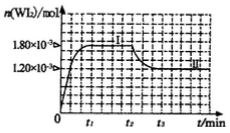
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=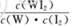
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时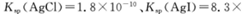
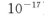 ]。
]。
参考答案:(1)A E F
(2)2Cl-+2H2O 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
(3)NaClO+CO2+ H2O=HClO+NaHCO3 ; 2HClO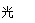 2HCl+O2↑。ClO-+Cl-+2H+= Cl2↑+H2O。
2HCl+O2↑。ClO-+Cl-+2H+= Cl2↑+H2O。
(4)① <?② 0.036/t1mol/(L·min) ③ B
(5)AgI? c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
本题解析:(1)在氯水中存在两种弱电解质,H2O、HClO。它们都存在着电离平衡H2O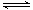 H++OH-;HClO
H++OH-;HClO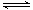 H++ClO-。正确。B. 向氯水中通入SO2,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,产生的H2SO4和HCl都没有漂白性。因此漂白作用减弱。C.向氯水中通入氯气,平衡:Cl2+H2O
H++ClO-。正确。B. 向氯水中通入SO2,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,产生的H2SO4和HCl都没有漂白性。因此漂白作用减弱。C.向氯水中通入氯气,平衡:Cl2+H2O 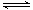 H++Cl-+HClO正向移动,c(H+) 增大,HClO
H++Cl-+HClO正向移动,c(H+) 增大,HClO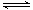 H++ClO-逆向移动,c(ClO-) 减小,c( H+)/c(ClO-)增大。错误。D.加水稀释氯水,溶液中的H+、ClO-、Cl-离子浓度减小,但由于c(H+)·c(OH-)=Kw.所以c(OH-)增大。错误。E.加水稀释氯水,由于Cl2+H2O
H++ClO-逆向移动,c(ClO-) 减小,c( H+)/c(ClO-)增大。错误。D.加水稀释氯水,溶液中的H+、ClO-、Cl-离子浓度减小,但由于c(H+)·c(OH-)=Kw.所以c(OH-)增大。错误。E.加水稀释氯水,由于Cl2+H2O 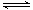 H++Cl-+HClO正向移动,酸电离产生的c(H+) 减小。对水的抑制作用减弱,所以水的电离平衡向正反应方向移动。正确。F.向氯水中加少量固体NaOH,发生反应Cl2+NaOH= NaCl+NaClO。若恰好完全反应则有c(Na+)=c(Cl- )+c(ClO-)。正确。所以正确选项为A、E、F。(2)氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O
H++Cl-+HClO正向移动,酸电离产生的c(H+) 减小。对水的抑制作用减弱,所以水的电离平衡向正反应方向移动。正确。F.向氯水中加少量固体NaOH,发生反应Cl2+NaOH= NaCl+NaClO。若恰好完全反应则有c(Na+)=c(Cl- )+c(ClO-)。正确。所以正确选项为A、E、F。(2)氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O 2OH-+ Cl2↑+H2↑.(3)由电离平衡常数H2CO3>HClO>HCO3-,可知:H2CO3>HClO,因此84消毒液露置在空气中发生反应的有关化学方程式NaClO+CO2+ H2O=HClO+NaHCO3。2HClO
2OH-+ Cl2↑+H2↑.(3)由电离平衡常数H2CO3>HClO>HCO3-,可知:H2CO3>HClO,因此84消毒液露置在空气中发生反应的有关化学方程式NaClO+CO2+ H2O=HClO+NaHCO3。2HClO 2HCl+O2↑若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会发生反应:ClO-+Cl-+2H+= Cl2↑+H2O产生有毒的气体Cl2导致中毒。(4)①因为升高温度,WI2的平衡含量降低,说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应,因此ΔH <0. ②从反应开始到t1时间内的平均反应速率v(I2) =v(WI2)= Δc/Δt=1.80×10-3mol/0.05L÷t1min="0.036/t1mol/(L·min)" .③A. 使用不纯的的W与I2发生反应制取气体WI2,当反应达到平衡后升高温度,平衡逆向移动,就能产生纯净的单质W。因此可利用该反应原理可以提纯钨。正确。B. 由于W是固体,浓度不会改变,所以该反应的平衡常数表达式是
2HCl+O2↑若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会发生反应:ClO-+Cl-+2H+= Cl2↑+H2O产生有毒的气体Cl2导致中毒。(4)①因为升高温度,WI2的平衡含量降低,说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应,因此ΔH <0. ②从反应开始到t1时间内的平均反应速率v(I2) =v(WI2)= Δc/Δt=1.80×10-3mol/0.05L÷t1min="0.036/t1mol/(L·min)" .③A. 使用不纯的的W与I2发生反应制取气体WI2,当反应达到平衡后升高温度,平衡逆向移动,就能产生纯净的单质W。因此可利用该反应原理可以提纯钨。正确。B. 由于W是固体,浓度不会改变,所以该反应的平衡常数表达式是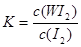 。错误。C.灯丝附近温度越高,结构平衡移动原理可知:灯丝附近区域WI2就会逆向移动,产生更多的W而重新沉积到灯丝上。正确。(5)由于Ksp(AgI)< Ksp(AgI).所以首先产生的沉淀为AgI。在混合前n(K+)=(5mL+5mL)×10-3L/mL×0.1mol/L=0.001mol;n(Ag+)=n(NO3-)=0.006L×0.1mol/L=0.0006mol;n(Cl-)=n(I-)=0.005L×0.1mol/L=0.0005mol;在混合溶液中K+、NO3-不消耗,发生反应:Ag++I-=AgI↓;Ag++Cl-=AgCl↓.根据消耗的微粒的物质的量,可确定溶液中离子的浓度大小关系为:c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
。错误。C.灯丝附近温度越高,结构平衡移动原理可知:灯丝附近区域WI2就会逆向移动,产生更多的W而重新沉积到灯丝上。正确。(5)由于Ksp(AgI)< Ksp(AgI).所以首先产生的沉淀为AgI。在混合前n(K+)=(5mL+5mL)×10-3L/mL×0.1mol/L=0.001mol;n(Ag+)=n(NO3-)=0.006L×0.1mol/L=0.0006mol;n(Cl-)=n(I-)=0.005L×0.1mol/L=0.0005mol;在混合溶液中K+、NO3-不消耗,发生反应:Ag++I-=AgI↓;Ag++Cl-=AgCl↓.根据消耗的微粒的物质的量,可确定溶液中离子的浓度大小关系为:c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
本题难度:困难
2、选择题 氯气是有毒的,曾被法西斯制成毒气弹用来侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是
[? ]
A.人、畜应躲到低洼的地方
B.人、畜应到较高的地方去
C.人应多饮豆浆和牛乳
D.可用肥皂水浸湿软布蒙面
参考答案:BD
本题解析:
本题难度:简单
3、填空题 (5分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为?。
(2)漂白粉的有效成分是(填化学式)?。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为?。
参考答案:(5分)(1)2Cl2 + 2 Ca(OH)2 ="=" Ca(ClO)2 + CaCl2 + 2H2O?(2分)
(2)Ca(ClO)2?(1分)
(3)Ca(ClO)2 + CO2 + H2O ="=" CaCO3↓+ 2 HClO?(2分)
本题解析:考查氯气的性质及其化合物的性质和用途等。
(1)氯气通入石灰乳中即生成漂白粉,反应等方程式是2Cl2 + 2 Ca(OH)2 ="=" Ca(ClO)2 + CaCl2 + 2H2O。
(2)漂白粉是混合物,主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙。
(3)由于碳酸的酸性强于次氯酸的,所以次氯酸钙能吸收空气中的CO2和水蒸气生成次氯酸,方程式是Ca(ClO)2 + CO2 + H2O ="=" CaCO3↓+ 2 HClO。
本题难度:一般
4、实验题 实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
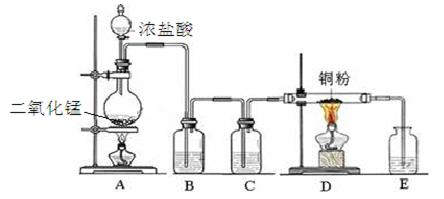
(1)写出烧瓶中发生反应的离子方程式 ?。
(2)B处盛有饱和食盐水(或水),其作用是?。
(3)C处盛放的试剂__________(填名称),其作用是?。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
参考答案:(10分) (1) MnO2 + 4H+ + 2Cl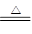 Mn2+ + 2H2O + Cl2↑
Mn2+ + 2H2O + Cl2↑
(2)除杂质H Cl气体(3)浓硫酸;吸收水份,干燥氯气
(4)NaOH 溶液,2OH- + Cl2=Cl- + ClO-+H2O?(5) D
本题解析:(1)装置A是制备氯气的,则反应的离子方程式是MnO2 + 4H+ + 2Cl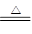 Mn2+ + 2H2O + Cl2↑。
Mn2+ + 2H2O + Cl2↑。
(2)盐酸易挥发,生成的氯气中含有氯化氢气体,则B处盛有饱和食盐水(或水)的作用是除杂质H Cl气体。
(3)和铜反应的氯气应该是干燥的,则C中盛放的是浓硫酸,用来干燥氯气。
(4)氯气有毒,则E中盛放的是氢氧化钠溶液,用来吸收氯气,防止污染空气,发生反应的离子方程式为2OH- + Cl2=Cl- + ClO-+H2O。
(5)由于在加热的条件下,铜容易被氧化生成氧化铜,所以实验结束时,应先熄灭D处酒精灯。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,也有助于调动学生的学习兴趣和学习积极性。
本题难度:一般
5、选择题 硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是( )
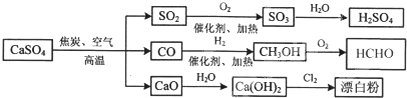
A.CO、SO2、SO3均是酸性氧化物
B.除去与水反应,图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
参考答案:A.CO不能与碱反应,不是酸性氧化物,故A错误;
B.除去与水反应,图示转化反应都是与氧气反应或氢气反应,都一定有化合价升降,均为氧化还原反应,故B正确;
C.澄清石灰水中氢氧化钙的浓度较小,应用纯净的消石灰,故C错误;
D.工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?

?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?

?CH3OH(g)+H2O(g)△H2
反应Ⅱ中不是所有原子进入期望产物,原子利用率不为100%,故D错误.
故选B.
本题解析:
本题难度:简单