1、选择题 下列排列顺序正确的是
A.常温下将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合,则c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.常温下物质的量浓度相等的①NH4HSO4、②CH3COONH4、③NH4Cl,三种溶液中c(NH4+):①>③>②
C.0.1 mol·L-1的NaHA溶液,其pH=11,则溶液中:
c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)<2c(H+)+c(CH3COOH)
参考答案:B
本题解析:A、混合后为等浓度的氨水和氯化铵,电离大于水解,故c(NH4+)>c(Na+);
B、①抑制铵根水解,②促进铵根水解,③正常水解,正确;
C、pH=11,水解大于电离,则有c(H2A)>c(A2-);
D、电荷守恒有c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ①;
物料守恒有2c(Na+)= c(CH3COO-)+c(CH3COOH)?②;
①×2+②,有c(CH3COO-)+2c(OH-)= 2c(H+)+c(CH3COOH)
本题难度:简单
2、选择题 在一定条件下,Na2CO3溶液存在水平平衡:CO2-3+H2O? ?HCO-3+OH-。下列说法正确的是?(?)
?HCO-3+OH-。下列说法正确的是?(?)
A.稀释溶液,上述可逆反应平衡常数不变
B.通入CO2,溶液pH增大
C.加入NaOH固体,平衡向正反应方向移动
D.升高温度,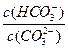 不变
不变
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列溶液加热蒸干后,能得到溶质本身固体的是
A.FeCl3
B.FeCl2
C.NaOH
D.NaHCO3
参考答案:C
本题解析:A、氯化铁溶液中存在铁离子的水解平衡,加热促进水解,且生成的氯化氢极易挥发,因此最终得到氢氧化铁固体,A不正确;B、氯化亚铁极易被氧化生成氯化铁,所以最终得到的是氢氧化铁,B不正确;C、氢氧化钠溶液蒸干后得到氢氧化钠固体,C正确;D、碳酸氢钠不稳定受热易分解生成碳酸钠,D不正确,答案选C。
本题难度:一般
4、选择题 若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
A.c(Na+)= c(Ac—)+c(HAc)
B.c(Na+)+c(OH—)= c(Ac— )+c(H+)
C.c(Na+)>c(OH—) > c(Ac—) > c(H+)
D.c(Na+)> c(Ac—)> c(H+)> c(OH—)
参考答案:A
本题解析:0.1mol·L-1 NaAc溶液中存在着Na+、Ac-、HAc、H+、OH-。其溶液中的三个守恒式为:①物料守恒:c(Na+)=c(Ac—)+c(HAc)=0.1mol·L-1 ;②电荷守恒:c(Na+)+c(H+)= c(Ac— )+c(OH—);③质子守恒:c(OH—)=c(H+)+c(HAc);由于离子的水解,故溶液中各离子的浓度大小关系为:c(Na+)> c(Ac—)> c(OH—)> c(H+)。综上,答案选A。
点评:解答此题的关键在于熟练掌握电解质溶液中的三个守恒:物料守恒、质子守恒和电荷守恒。同时,应充分考虑弱离子的电离与水解。属于中档题。
本题难度:一般
5、选择题 在10mL 0.1mol·L—1NaOH溶液中加入同体积同浓度的CH3COOH溶液,反应后溶液中各粒子浓度关系错误的是:
A.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
B.c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
C.c(Na+)=c(CH3COO—)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO—)+c(OH—)
参考答案:A
本题解析:混合后为醋酸钠的溶液;该溶液水解呈碱性故有c(Na+)>c(CH3COO—)>c(OH—)>c(H+),A错误,B正确;C、为物料守恒;D、为电荷守恒。
本题难度:简单