1、填空题 写出以SiO2为原料制备H2SiO3的化学方程式___________________________。
参考答案:不矛盾;原因见上。
本题解析:本题利用CO2、SiO2、Na2SiO3、H2CO3、H2SiO3等化合物的性质,考查同学们的逻辑推理能力以及思维的敏捷性和深刻性。反应①是在溶液中进行的反应,反应之所以能够发生,是由于酸性H2CO3>H2SiO3,反应符合“强酸制弱酸”的复分解反应原理;而反应②是在高温熔融状态下的反应,由于CO2可从熔融体中逸出,使得反应可以发生,而与酸性H2CO3>H2SiO3无关。
点评:①是在水溶液中进行的复分解反应,②是固体与固体之间的反应(非水条件);①是常温下的反应,②是高温条件下的反应。两个反应的条件不同,实质上没有可比性,因为它们的反应原理、反应条件与本质均不同。
本题难度:简单
2、填空题 (14分)一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体。
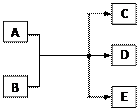
(1)若A、C、D均含氯元素,C为氯碱工业的原料,
D溶液具有漂白性,则A与B反应的化学方程式是?;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是?;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是?,G遇硝酸蒸气的现象是?。
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体。A与B反应的化学是?;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是?。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是?。
参考答案:(14分,每空2分)(1) Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-);
NH4++HCO3-+2OH- = -CO32-+NH3↑+2 H2O;产生白烟?。
(2)Cu+2H2SO4(浓)(14分,每空2分)(1) Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-);
NH4++HCO3-+2OH- = -CO32-+NH3↑+2 H2O;产生白烟?。
(2)Cu+2H2SO4(浓)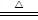 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
(3)取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色(合理答案均得分)。 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
(3)取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色(合理答案均得分)。
本题解析:略
本题难度:一般
3、填空题 现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
 ?
?
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: A?,丙?
(2)写出反应②的化学方程式?
(3)写出下列反应离子方程式:
反应③?
反应⑤?
反应⑥?
参考答案:(1)Na? HCl
(2)H2+Cl2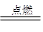 2HCl
2HCl
(3)反应③:2Al+2H2O+2OH-=2AlO2-+3H2↑
反应⑤:2Fe2++ Cl2=?2Fe3+ +2Cl-?反应⑥:Fe3++ 3OH-=?Fe(OH)3↓
本题解析:金属单质A的焰色反应为黄色,应为Na,与水反应生成的气体甲为H2,D为NaOH,黄绿色气体乙为Cl2,则丙为HCl,E为盐酸,能与NaOH反应生成氢气的B为Al,红褐色沉淀H为Fe(OH)3,则C为Fe,F为FeCl2?,G为FeCl3,(1)由以上分析可知A为Na,丙为HCl故答案为:Na;HCl(2)反应②为H2+Cl2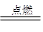 2HCl(3)反应③的化学方程式为:2Al+2NaOH +2H2O==2NaAlO2 + 3H2↑,离子方程式为:2Al+2H2O+2OH-==2AlO2-+3H2↑;反应⑤为FeCl2和Cl2的反应,方程式为2FeCl2+Cl2═2FeCl3,离子方程式为:2Fe2++Cl2="2" Fe3++2Cl-?反应;⑥为FeCl3和NaOH的反应,方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl,离子方程式为:Fe3+ +3OH-═Fe(OH)3↓。
2HCl(3)反应③的化学方程式为:2Al+2NaOH +2H2O==2NaAlO2 + 3H2↑,离子方程式为:2Al+2H2O+2OH-==2AlO2-+3H2↑;反应⑤为FeCl2和Cl2的反应,方程式为2FeCl2+Cl2═2FeCl3,离子方程式为:2Fe2++Cl2="2" Fe3++2Cl-?反应;⑥为FeCl3和NaOH的反应,方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl,离子方程式为:Fe3+ +3OH-═Fe(OH)3↓。
本题难度:一般
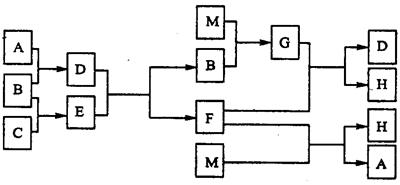
4、填空题 在元素周期表短周期元素中,A、B、C、M是单质。M是一种日常常用金属,有关转化如图:
请回答:
(1)元素M在元素周期表的位置:?周期,?主族。
(2)①写出B与C在加热条件下反应的化学方程式:?
② C与D反应的化学方程式为:?
③写出M与F的水溶液反应的离子方程式:?
(3)将1mol E和1mol碳酸氢钠混合放在密闭容器中加热,加热至300℃经充分反应后排出气体。
写出:
①容器内残留的固体物质名称及其物质的量?;
②在容器中发生的化学反应的化学方程式:?;
参考答案:(15分)
(1)三,ⅢA(各1分)
(2)2Na+O2?Na2O2(2分)? 2Na+2H2O=2NaOH+H2↑(2分)
(3)2Al+2OH—+2H2O?2AlO2—+3H?2↑(2分)
(4)碳酸钠(1分),1mol(1分),氢氧化钠(1分) 1mol(1分)
2NaHCO3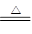 Na2CO3+H2O↑+CO2↑? 2Na2O2+2CO2
Na2CO3+H2O↑+CO2↑? 2Na2O2+2CO2?2Na?2CO3+O2
2Na2O2+2H2O===4NaOH+O2(每个1分)
本题解析:一定要注意本题所涉及的元素均为短周期元素,M是一种日常常用金属,可知M为铝。铝和单质B可反应,根据B的化合物及性质,可猜测B为氧气;进而可知D、E分别是由A、C和氧气反应得到,均为氧化物且可反应产生氧气,可推测出D、E应该是Na2O2、CO2或Na2O2、H2O;再由D、E的产物F可与铝反应可知D、E应该是Na2O2、H2O反应生成了F:NaOH。由F(NaOH)与M(铝)反应生成了A与H,可知A为氢气。
到此为止,可知A、B、C分别为氢气、氧气、钠单质。
(3)将1mol Na2O2和1mol碳酸氢钠混合放在密闭容器中加热,发生下列反应:
2NaHCO3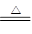 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
2Na2O2+2CO2?2Na?2CO3+O2
2Na2O2+2H2O===4NaOH+O2(每个1分)
NaHCO3分解产生的两个气体恰好与Na2O2反应生成相应的产物。
本题难度:一般
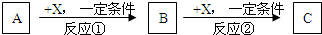
5、填空题 A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去).
试回答:
(1)若X是强氧化性单质,则A不可能是______.
a.S?b.N2?c.Na?d.Mg?e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为______;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)______.检验此C溶液中金属元素价态的操作方法是______.
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______,X的化学式可能为(写出不同类物质)______或______.反应①的离子方程式为______.
参考答案:(1)若X是强氧化性单质,由转化关系AX
本题解析:
本题难度:一般