1、选择题 能正确表示下列反应的离子方程式的是
A.硫化氢气体通入足量氢氧化钠溶液中:H2S+2OH—=S2—+2H2O
B.铁与足量稀硝酸反应:Fe+2H+=Fe2++H2↑
C.氯化铁溶液与浓氨水反应:Fe3++3OH—=Fe(OH)3↓
D.Al2O3溶于盐酸:Al2O3+6H+ =2Al3++3H2O
参考答案:AD
本题解析:
正确答案:A D
B.不正确,铁与足量稀硝酸反应:Fe+4H++NO3―=Fe3++NO↑+2H2O
C.不正确,氯化铁溶液与浓氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
本题难度:一般
2、选择题 下列反应中,可用离子方程式H++OH-=H2O表示的是
A.NH4Cl+NaOH NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.NaOH+HNO3=NaNO3+H2O
C.M g(OH)2+2HCl=MgCl2+2H2O
D.NaOH +NaHCO2=NaHCO3+H2O
参考答案:B
本题解析:根据离子方程式H++OH-=H2O可知,该反应属于强酸和强碱反应,且生成的盐是可溶性的,所以选项B正确,其余选项都是错误的,答案选B。
点评:由于离子方程式不但可以表示具体的反应,还可以表示某一类反应,所以可能会有多个化学方程式对应同一个离子方程式,因此在具体判断时需要注意。
本题难度:一般
3、选择题 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO 2体积(V)的关系如图,图中AB段表示的先后离子方程式是(?)
2体积(V)的关系如图,图中AB段表示的先后离子方程式是(?)
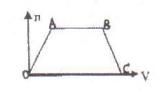
①CO2+OH-=HCO3-
②CO2+2OH-=CO32-+H2O
③CO32-+Ba2+=BaCO3↓
④BaCO3+CO2+H2O=Ba2++2HCO3-
⑤CO32-+CO2+H2O=2HCO3-
A.②⑤
B.⑤④
C.④②
D.④①
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列离子方程式书写正确的是
[? ]
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.向NaAlO2溶液中加盐酸至溶液呈酸性:A1O2-+4H+=Al3++2H2O
C.向碳酸氢铵溶液中加入过量的NaOH溶液:HCO3-+OH-=CO32-+H2O
D.Cl2与H2O反应:Cl2+H2O=2H++Cl-+C1O-
参考答案:B
本题解析:
本题难度:一般
5、选择题 向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4+ + SO42—+ Ba2+ +OH— BaSO4↓+ NH3·H2O
BaSO4↓+ NH3·H2O
B.2Al3+ + 3SO42—+3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓
3BaSO4↓+ 2Al(OH)3↓
C.Al3+ + 2SO42—+ 2Ba2+ + 4OH— 2BaSO4↓+ AlO2—+ 2H2O
2BaSO4↓+ AlO2—+ 2H2O
D.NH4++Al3+ +2SO42—+2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O
2BaSO4↓+ Al(OH)3↓+ NH3·H2O
参考答案:BD
本题解析:铵明矾[NH4Al(SO4)2?12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,硫酸根沉淀钡离子,同时氢氧根离子沉淀铝离子,随滴入的氢氧化钡增多,硫酸根离子全部沉淀,同时铝离子沉淀完全,过量的氢氧根离子和铵根离子结合生成一水合氨,氢氧化铝不能溶解在氨水中,继续滴入氢氧化钡,氢氧化铝沉淀溶解,依据离子反应顺序书写离子方程式判断;A、反应中氢氧化钡先生成硫酸钡沉淀和氢氧化铝沉淀;故A错误;B、NH4Al(SO4)2和Ba(OH)2按照2:3混合反应生成硫酸钡沉淀、氢氧化铝沉淀、此时硫酸根离子过量,反应的离子方程式为2Al3+ + 3SO42—+3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓,B正确;C、NH4Al(SO4)2和Ba(OH)2按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入氢氧化钡0.5mol,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3?H2O+AlO2-+2H2O,C不正确;D、NH4Al(SO4)2和Ba(OH)2按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,反应的离子方程式为NH4++Al3+ +2SO42—+2Ba2+ +4OH—
3BaSO4↓+ 2Al(OH)3↓,B正确;C、NH4Al(SO4)2和Ba(OH)2按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入氢氧化钡0.5mol,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3?H2O+AlO2-+2H2O,C不正确;D、NH4Al(SO4)2和Ba(OH)2按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,反应的离子方程式为NH4++Al3+ +2SO42—+2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O,故D正确,答案选BD。
2BaSO4↓+ Al(OH)3↓+ NH3·H2O,故D正确,答案选BD。
本题难度:简单