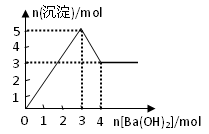
1、选择题 右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
A.MgSO4
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
参考答案:B
本题解析:观察图可以看到沉淀先增多、再减少、最后不变,再结合Ba(OH)2,可断定成分含有Al3+和SO42-。故选B。
点评:本题考查的是无机反应和化学计算的知识,分析清楚发生化学反应的原理是解题的关键,题目难度适中。
本题难度:简单
2、选择题 “嫦娥一号”需完成的四大科学目标之一是探测下列14种元素在月球的含量和分布:K、Th、U、O、Si、Mg、A1、Ca、Fe、 Ti、Na、Mn、Cr、Gd,其中属于短周期元素的有
[? ]
A.4种
B.5种
C.6种
D.7种
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列实验的操作和结论正确的是
A.将0.1 mol Na和少量 Al 片放入水溶液中,放出气体刚好是0.05 mol
B.Na2O2投入到 FeCl2溶液中只得到大量白色沉淀
C.镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉
D.配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大
参考答案:C
本题解析:A.2Na+2H2O=2NaOH+H2,2Al+6H2O=2Al(OH)3+3H2,2molNa和少量 Al 片与水反应共放出氢气4mol,因此0.1mol反应产生的气体为0.2mol,故错误。B. Na2O2投入到 FeCl2溶液,Na2O2先与溶液中的水发生2Na2O2+2H2O=4NaOH+O2↑反应,产生氧气,FeCl2与产生的NaOH反应生成Fe(OH)2白色沉淀,由于Fe(OH)2不稳定,白色沉淀会迅速变成灰绿色,最后变为红褐色。反应现象中还应产生气体,故错误。C. 镁粉中混有铝粉,当与NaOH溶液反应时,Mg与NaOH溶液不发生反应,而Al则与过量的NaOH溶液反应生成氢气与NaAlO2,经过过滤可得到镁粉,故正确。D.在配制一定物质的量浓度溶液时,定容时仰视刻度线,会使加入的水的体积超过刻度线,使溶液的体积偏大,致使溶液浓度偏小。3的两性、配制一定浓度的溶液时的误差问题。
本题难度:一般
4、填空题 按要求填空:
(1)与Ne原子电子层结构相同的-2价阴离子,填写微粒的结构示意图:___________________;
(2)用电子式表示两核10电子的共价化合物形成过程:___________________________;
(3)在1~18号元素中,气态氢化物的水溶液呈碱性的化合物的结构式:__________ 。
(4)相对分子质量为58的烷烃的分子式是_______________,它可能的结构简式是 ______________________________________________
参考答案:“略”
本题解析:
本题难度:一般
5、填空题 (8分)资料1:精制碘盐的成分为NaCl和KIO3,其中碘的含量为20~40mg·kg-1。
资料2:日本地震导致福岛两座核电站反应堆发生故障,铯和碘的放射性同位素大量外泄。
资料3:专家认为,每天服用1片碘片(含碘量100mg)可有效减小人体甲状腺对放射性碘的吸收。
请认真阅读以上资料,并回答下列问题:
⑴铯在周期表中的位置是?。
⑵下列物质中与KIO3含有化学键类型相同的是?(填序号)。
①HIO3?②碘酸钠?③KOH?④I2O5?⑤NaCl
⑶向碘盐的溶液中加入 www.91eXam.org白醋和KI,再滴入淀粉溶液,溶液呈蓝色,则发生反应的离子方程式为?。
⑷若用精制碘盐来预防放射性碘对人体的伤害,是否可行??(填“行”、“不行”),原因是?。
参考答案:(1)第6周期 IA?(2)②③?(3)IO3-+5I-+6CH3COOH=3I2+6CH3COO- +3 H2O
(4)不行,因为从精制食盐中摄入的碘量达不到规定的量
本题解析:(1)根据铯在周期表中的未知可知,铯位于第6周期 IA。
(2)KIO3含有离子键和共价键,所以答案选②③。
(3)碘酸钾具有氧化性,能氧化碘化钾,方程式为IO3-+5I-+6CH3COOH = 3I2+ 6CH3COO- + 3 H2O。
(4)因为每天从精制食盐中摄入的碘量达不到规定的100毫克,所以是不行的。
点评:本题综合性较强,难度较小,主要考查学生的基础知识。
本题难度:一般