1、选择题 下列实验操作或说法错误的是
①用稀硫酸清洗做焰色反应的铂丝
②为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体
③称量固体烧碱应在托盘上放称量纸,再将烧碱放在纸上称量
④配制浓硫酸和浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中
⑤用滴定管和量筒分别量取一定量的溶液,终读时仰视刻度,读数都偏高.
A.①②③④
B.②③④⑤
C.①②④⑤
D.①②③⑤
2、选择题 下列实验操作或结论正确的是?
[? ]
A.经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质
B.用加热法可以分离KMnO4和碘单质的混合物
C.配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶
D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
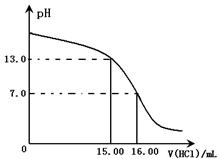
3、实验题 Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴?定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图)。实验过程中需要使用的仪器有?。(选填下列仪器对应的字母)
由下图可知NaOH溶液的物质的量浓度为?。(忽略溶液混合时体积和温度的变化)
Ⅱ.该小组四位同学在做实验时,发现了一个意外现象:向上述NaOH溶液中滴入酚酞溶液,开始时溶液变红,一会儿红色就消失了。对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计。
[猜想]甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度的大小有关。
[理论分析]
(1)丙同学认为乙同学的猜想也不正确,他的理由是?
?
[实验设计]
(2)为证实丙同学的猜想,还需做如下实验,请完成下表:
实验步骤
| 设计这一步骤的目的
|
1.将配制的氢氧化钠溶液加热
| ①?
|
2.在加热后的溶液中滴加酚酞,并在上方滴一些植物油
| ②利用植物油隔绝
|
(3)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,设计如下实验证明并完成有关问题:
实验方法
| 观察到的现象和结论
|
方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。
| 浓度大的溶液中酚酞红色会消失,则证明红色消失与氢氧化钠溶液的浓度大小有关
|
方案二:向原红色消失的溶液中加?①?
(填试剂名称)
| ?②?
4、选择题 某学生在配制100 mL 1 mol·L-1的NaOH溶液时,最终配制的溶液浓度比要求的低,
造成该误差的原因可能是(?)
A.天平没调平衡,静止时指针指向分度盘右边
B.定容时仰视刻度线
C.冲洗烧杯的洗涤液全部转移到容量瓶中
D.定容时俯视刻度线
5、选择题 下列实验操作与对应的反应现象或原理正确的一组是(?)
选项
| 实验操作
| 现象或原理
| A
| 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置
| 溶液分层,下层呈紫红色
| B
| 将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中
| 均先沉淀后溶解
| C
| 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解
| 浓盐酸氧化性强于浓硝酸
| D
| 将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液
| 溶液物质的量浓度为1.0mol﹒L-1
|
?
|