1、选择题 下列实验操作或说法错误的是
①用稀硫酸清洗做焰色反应的铂丝
②为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体
③称量固体烧碱应在托盘上放称量纸,再将烧碱放在纸上称量
④配制浓硫酸和浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中
⑤用滴定管和量筒分别量取一定量的溶液,终读时仰视刻度,读数都偏高.
A.①②③④
B.②③④⑤
C.①②④⑤
D.①②③⑤
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列实验操作或结论正确的是?
[? ]
A.经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质
B.用加热法可以分离KMnO4和碘单质的混合物
C.配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶
D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
参考答案:A
本题解析:
本题难度:简单
3、实验题 Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴?定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图)。实验过程中需要使用的仪器有?。(选填下列仪器对应的字母)
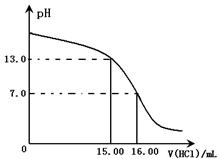
由下图可知NaOH溶液的物质的量浓度为?。(忽略溶液混合时体积和温度的变化)
Ⅱ.该小组四位同学在做实验时,发现了一个意外现象:向上述NaOH溶液中滴入酚酞溶液,开始时溶液变红,一会儿红色就消失了。对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计。
[猜想]甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度的大小有关。
[理论分析]
(1)丙同学认为乙同学的猜想也不正确,他的理由是?
?
[实验设计]
(2)为证实丙同学的猜想,还需做如下实验,请完成下表:
实验步骤
| 设计这一步骤的目的
|
1.将配制的氢氧化钠溶液加热
| ①?
|
2.在加热后的溶液中滴加酚酞,并在上方滴一些植物油
| ②利用植物油隔绝
|
(3)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,设计如下实验证明并完成有关问题:
实验方法
| 观察到的现象和结论
|
方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。
| 浓度大的溶液中酚酞红色会消失,则证明红色消失与氢氧化钠溶液的浓度大小有关
|
方案二:向原红色消失的溶液中加?①?
(填试剂名称)
| ?②?
参考答案:ABDHJ?(2分) ;? 4.0mol/L(2分)
Ⅱ.?(1)因为NaOH与空气中的CO2反应后的产物是Na2CO3,溶液仍然呈碱性。(1分)
(2)①除去溶液的氧气(1分)?
(3)①水?②红色重新出现,则说明红色消失与氢氧化钠溶液浓度大小有关。(1分)
本题解析:Ⅰ.考查中和滴定实验,根据实验原理可知需要的仪器是ABDHJ;根据图像可知,终点是消耗盐酸是16.00ml。当加入15.00ml盐酸时,溶液的pH=13,所以如果设氢氧化钠和盐酸的浓度分别是xy,则有10x=16y、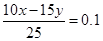 ,解得x=4.0mol/L,y=2.5mol/L。 ,解得x=4.0mol/L,y=2.5mol/L。
Ⅱ、(1)因为NaOH与空气中的CO2反应后的产物是Na2CO3,溶液仍然呈碱性,所以溶液还应该是红色的。
(2)①由于气体的溶解度随温度的升高而降低,所以加热可以除去溶液的氧气。
(3)根据实验方案一可知,浓度大的颜色消失,因此可以通过降低氢氧化钠溶液的浓度来进行对比,即向原红色消失的溶液中加入水,红色重新出现,则说明红色消失与氢氧化钠溶液浓度大小有关。
本题难度:一般
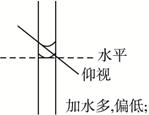
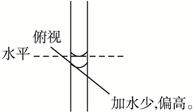
4、选择题 某学生在配制100 mL 1 mol·L-1的NaOH溶液时,最终配制的溶液浓度比要求的低,
造成该误差的原因可能是(?)
A.天平没调平衡,静止时指针指向分度盘右边
B.定容时仰视刻度线
C.冲洗烧杯的洗涤液全部转移到容量瓶中
D.定容时俯视刻度线
参考答案:B
本题解析:A.静止时指针指向分度盘右边,相当于需在左盘中加入一些药品才能将天平调平衡,所以,所称物质质量偏大,浓度偏高。C是正确操作。
 ? ?
本题难度:简单
5、选择题 下列实验操作与对应的反应现象或原理正确的一组是(?)
选项
| 实验操作
| 现象或原理
| A
| 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置
| 溶液分层,下层呈紫红色
| B
| 将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中
| 均先沉淀后溶解
| C
| 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解
| 浓盐酸氧化性强于浓硝酸
| D
| 将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液
| 溶液物质的量浓度为1.0mol﹒L-1
|
?
参考答案:B
本题解析:A.发生反应:Cl2+2I-=I2+2Cl-。I2容易溶解在苯等有机溶剂中,而苯的密度比水小,难溶于水,所以再加入少量苯,振荡、静置,会看到溶液分层,上层呈紫红色。错误。B. 胶体的表面积大,能吸附电荷。金属氢氧化物的胶体吸附正电荷。胶粒之间有排除力,所以胶体能稳定存在。当向胶体中加入电解质时,胶粒上的电荷被中和发生聚沉现象。若向其中加入稀盐酸或氢氧化钠溶液,由于氢氧化铝是两性氢氧化物,既能与强酸发生反应,也能与强碱发生反应,产物都容易溶解在水中,所以,均先沉淀后溶解现象。正确。C. 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,形成王水,能产生新的强氧化剂,所以能够将铂、金溶解。不是浓盐酸氧化性强于浓硝酸。错误。D.溶液的物质的量浓度是用位体积的溶液中溶质的物质的量的多少来表示溶液组成的物理量。不是指溶剂的体积。错误。
本题难度:一般
|