|
高中化学知识点讲解《物质的量》高频考点特训(2019年练习版)(六)
2019-06-25 20:56:54
【 大 中 小】
|
1、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.1molNH3催化氧化完全转变为NO时,转移5×6.02×1023e-
B.-140℃下,92g四氧化二氮晶体,恢复到标准状况时,N2O4分子数为6.02×1023个
C.3.9g过氧化钠中含有6.02×1023个O2-离子
D.1mol 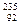 U核素,含有235×6.02×1023个中子 U核素,含有235×6.02×1023个中子
参考答案:A
本题解析:四氧化二氮气体中存在和二氧化氮相互转化的平衡,故92g N2O4气体中的四N2O4分子的物质的量并不是1mol,B错误;过氧化钠中的阴离子并不是O2-而是O22-,C错误;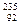 U原子中并没有235个中子,事实上只有143个中子,D错误。 U原子中并没有235个中子,事实上只有143个中子,D错误。
本题难度:一般
2、实验题 (15分)实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,回答下列问题:
(1)请简要叙述该实验的主要实验步骤:
①__________________;②__________________;
③__________________;④__________________;
⑤__________________;⑥__________________。
(2)所需仪器为:容量瓶(规格为________)、托盘天平,还需要哪些实验仪器才能完成该实验,请写出:_________________________________________
(3)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有_______________;偏小的有 ;无影响的有 。
A.称量时使用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶中移液时,有少量液体溅出
| E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线
参考答案:(1)计算 称量 溶解 移液 洗涤 定容(1分)
(2)500 mL(1分) 烧杯、玻璃棒、胶头滴管(2分)
(3)AC BDEFH G (2分)
本题解析:实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,故配制溶液需选用500ml的容量瓶,还需用到的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管;主要步骤为:计算 称量 溶解 移液 洗涤 定容;根据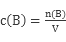 可知,称量时使用了生锈的砝码导致所取NaOH的质量偏大,n(B)偏大故会导致所配溶液浓度偏高;将NaOH放在纸张上称量,由于NaOH有很强的吸湿性,故用纸片称量NaOH会导致一部分NaOH残留在纸片,故会导致进入容量瓶的NaOH量偏少,故导致所配浓度偏低;NaOH在烧杯中溶解放热,未冷却就立即转移到容量瓶中定容,会导致冷却后体积V偏小,故导致所配溶液浓度偏高;往容量瓶中移液时,有少量液体溅出,会导致进入容量瓶的n(B)偏小,故会导致所配溶液浓度偏低;未洗涤溶解NaOH的烧杯,会导致进入容量瓶的n(B)偏小,故会导致所配溶液浓度偏低;定容时仰视刻度线会导致所配溶液体积V偏大,故会导致溶液浓度偏低;容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响;定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,是因为振荡导致刻度线上方残留溶液,再加水至刻度线会导致所配溶液浓度偏低。 可知,称量时使用了生锈的砝码导致所取NaOH的质量偏大,n(B)偏大故会导致所配溶液浓度偏高;将NaOH放在纸张上称量,由于NaOH有很强的吸湿性,故用纸片称量NaOH会导致一部分NaOH残留在纸片,故会导致进入容量瓶的NaOH量偏少,故导致所配浓度偏低;NaOH在烧杯中溶解放热,未冷却就立即转移到容量瓶中定容,会导致冷却后体积V偏小,故导致所配溶液浓度偏高;往容量瓶中移液时,有少量液体溅出,会导致进入容量瓶的n(B)偏小,故会导致所配溶液浓度偏低;未洗涤溶解NaOH的烧杯,会导致进入容量瓶的n(B)偏小,故会导致所配溶液浓度偏低;定容时仰视刻度线会导致所配溶液体积V偏大,故会导致溶液浓度偏低;容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响;定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,是因为振荡导致刻度线上方残留溶液,再加水至刻度线会导致所配溶液浓度偏低。
考点:一定物质的量浓度溶液的配制。
本题难度:一般
3、选择题 下列说法正确的是
A.1 molCl2含有6.02×1023个微粒
B.阿伏加德罗常数数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量
D.H2O的摩尔质量是18 g
参考答案:B
本题解析:A不正确,没有指明是什么微粒;C不正确,应该是如果用g/mol作单位时;D不正确,摩尔质量的单位是g/mol,所以正确的答案选B。
本题难度:简单
4、计算题 (8分)某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 ml 5 mol/L HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是__________________。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是多少毫升?沉淀的最大质量为多少克?(用含a的代数式表示)。
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数。
参考答案:(8分)(1)2.7<a<3.6?(2)250? ,a+5.1?(3)40%
本题解析:(1)标准状况下3.36L气体的物质的量是3.36L÷22.4L/mol=0.15mol。根据反应的方程式2Al+6H+=2Al3++3H2↑、Mg+2H+=Mg2++H2↑可知,如果全部是铝生成的氢气,则铝的质量是0.1mol×27g/mol=2.7g。如果全部是镁生成的,则镁的质量是0.15mol×24g.mol=3.6g,所以a的取值范围是2.7<a<3.6。
(2)当沉淀质量达到最大值时,溶液中的溶质恰好是氯化钠,所以根据原子守恒可知,需要氢氧化钠的物质的量是0.2L×5mol/L=1mol,则需要氢氧化钠溶液的体积是1mol÷4mol/L=0.25L=250ml。镁或铝失去多少电子,相应的计算阳离子就结合多少OH-生成相应的氢氧化物沉淀。氢气是0.15mol,转移0.3mol电子。所以和金属阳离子结合的OH-的物质的量就是0.3mol,则沉淀的质量就是ag+0.3mol×17g/mol=(a+5.1)g。
(3)根据实验现象可知,过滤得到的白色沉淀是氢氧化镁,灼烧则生成氧化镁,这说明氧化镁的质量和原混合物的质量相等。由于镁原子的质量没有改变,因此原混合物中铝的质量分数就是氧化镁中氧元素的质量分数,即为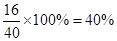 。 。
点评:该题的反应过程比较复杂,有关的化学方程式也比较多。该题的解题思路仍然是抛弃反应过程,根据最终的结果,充分利用各种解题技巧,抓住问题的关键,化繁为简。该题的难度较大,对学生的思维要求较高。既考查了学生的对基础知识的熟练程度,更重要的是考查学生灵活运用知识解决实际问题的解题能力。
本题难度:一般
5、选择题  表示阿伏加德罗常数,下列说法中正确的是 表示阿伏加德罗常数,下列说法中正确的是
A.2.4g镁与足量的盐酸反应,电子转移数目为0.1
B.0.5mol/L的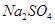 的溶液中含 的溶液中含 个 个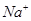
C.1mol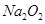 固体中含2 固体中含2 个阴离子 个阴离子
D.1mol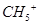 离子所含电子数为10 离子所含电子数为10
参考答案:D
本题解析:A、2.4g镁为0.1mol,与足量的盐酸反应,电子转移数目为0.2NA,错误;B、没有指明溶液的体积,无法计算微粒的数目,错误;C、O22?为1个离子,所以1mol Na2O2固体中含NA个Na+,错误;D、CH5+含有10个电子,所以1molCH5+离子含电子数为10 NA,正确。
本题难度:一般
|