1、选择题 在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A.N2O4和NO2的分子数比为1∶2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色不再改变
D.单位时间内有1 mol N2O4变为NO2的同时,有2 mol NO2生成
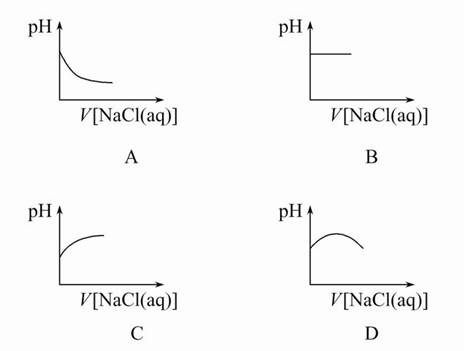
2、选择题 向新制备的氯水中不断滴入饱和NaCl溶液,则下列曲线符合氯水pH变化的是(? )
3、选择题 在一定温度下,向a L体积固定的密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g) + 2Y(g)  3Z(g)。下列说法不正确的是
3Z(g)。下列说法不正确的是
A.容器内压强不随时间变化而变化
B.某一时刻,容器内各物质的浓度有可能相等
C.达到平衡时,单位时间内生成3n mol Z,同时生成 2n mol Y
D.X,Y的转化率相等
4、简答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g)?△H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。?其他条件不变时,下列措施不能使NO2转化率提高的是 ??
N2O4(g)?△H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。?其他条件不变时,下列措施不能使NO2转化率提高的是 ??
A.减少NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
 N2O4(g)的平衡常数K=?。
N2O4(g)的平衡常数K=?。