1、填空题 A~G各物质间的关系如图,其中B、D为气态单质。
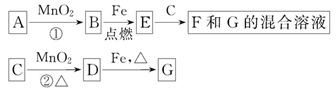
请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________;若只能在加热情况下进行,则反应物A应为______________;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为________________________________________。
参考答案:(1)浓盐酸?四氧化三铁
(2)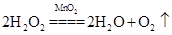 ? KClO3
? KClO3
(3)催化剂?氧化剂?
(4)铁屑? KSCN溶液?溶液呈红色
本题解析:解答本题注意以下两点:
(1)MnO2常用作催化剂和制Cl2的氧化剂。
(2)Fe为变价金属,Fe2+易被氧化。
由转化关系图可推出B、D一个是Cl2,一个是O2,E和C反应生成F和G的混合物,可确定B为O2,D为Cl2,则C为浓盐酸,G为FeCl3,E为Fe3O4,F为FeCl2,根据实验室制O2的反应条件可知,常温下发生①,则A为H2O2,加热条件下发生①,则A为KClO3,为了防止Fe2+被氧化,在其溶液中常加入铁屑,检验Fe3+常用的试剂为KSCN溶液,实验现象为溶液呈红色。
本题难度:一般
2、实验题 某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题:
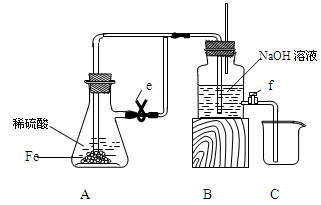
(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。
参考答案:(1)Fe + 2H+ = Fe2+ + H2↑ ?导管口有气泡冒出?
(2)A中溶液进入B,立即产生白色沉淀?H+ + OH-= H2O,? Fe2+ + 2OH-= Fe(OH)2↓
(3)沉淀逐渐变成灰绿色,最终变成红褐色,? 4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
本题解析:Fe与稀硫酸发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑其离子方程式为:Fe + 2H+ = Fe2+ + H2↑。A中产生的气体通过导气管到B的溶液中,会看到在导气管口产生气泡。(2)数分钟后夹上夹子e,A中还在继续反应产生气体,使容器A的气压增大,这时A中反应产生的FeSO4就会被压入到B容器中,与NaOH溶液反应产生白色Fe(OH)2沉淀。B中反应的离子方程式是H+ + OH-= H2O,Fe2+ + 2OH-= Fe(OH)2↓(3)如果开启活塞f放掉约2/3液体,因为空气的进入,白色不稳定的Fe(OH)2会被氧化为红褐色的Fe(OH)3.因此此时试剂瓶B中可能出现的现象是沉淀逐渐变成灰绿色,最终变成红褐色。反应的化学方程式是4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3。2的制取与性质的知识。
本题难度:一般
3、选择题 用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是
A.铜 硝酸铜
硝酸铜
B.铜 硝酸铜
硝酸铜
C.
D.
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下表A—D各项中,在有乙与甲共存的情况下,用丙检验甲的存在,不能成功的是(不得使用加热、边滤、萃取等实验操作)(?)
序号
| 甲
| 乙
| 丙
|
A
| 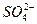
| 
| 稀盐酸、BaCl2溶液
|
B
| I-
| Cl-
| AgNO3溶液
|
C
| Fe2+
| Fe3+
| KSCN溶液
|
D
| Al3+
| Ag+
| 稀氨水
参考答案:C
本题解析:A选项中盐酸能除去SO23-,不影响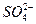 的检验。B选项中AgCl为白色沉淀,AgI为黄色沉淀,故Cl-的存在不影响I-的检验。C选项中Fe3+与SCN-反应使溶液变血红色,干扰Fe2+的检验。D选项中氨水过量时Ag+转为[Ag(NH3)2]+,Al3+转化为Al(OH)3白色沉淀,故Ag+的存在不影响Al3+的检验。 的检验。B选项中AgCl为白色沉淀,AgI为黄色沉淀,故Cl-的存在不影响I-的检验。C选项中Fe3+与SCN-反应使溶液变血红色,干扰Fe2+的检验。D选项中氨水过量时Ag+转为[Ag(NH3)2]+,Al3+转化为Al(OH)3白色沉淀,故Ag+的存在不影响Al3+的检验。
本题难度:简单
5、选择题 上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟的困扰.你估计这一空气污染物是因为含有( )
A.FeO粉尘
B.Fe2O3粉尘
C.Fe粉尘
D.碳粉
参考答案:B
本题解析:
本题难度:简单
|