1、选择题 家用液化石油气钢瓶如出现裂纹,容易造成液化气泄漏,引发火灾。检验家用液化石油气钢瓶完好性的方法之一是:在被怀疑有裂纹处涂上稀盐酸,过一段时间后,若观察到有粗线裂纹,表明该处确实有原先看不见的细裂纹,要将该钢瓶作报废处理。你认为产生粗裂纹的主要原因是
[? ]
A.原裂纹处油漆过厚
B.裂纹处表面积很大,铁与盐酸反应较快
C.裂纹处的尘埃对铁与盐酸的反应起催化作用
D.裂纹处有氧化铁积存,并与盐酸作用生成可溶性盐
参考答案:D
本题解析:
本题难度:简单
2、选择题 CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是
A.铜片做阴极,石墨做阳极
B.白色沉淀在阴极附近生成
C.阳极区溶液变蓝的原因是:2Cu+4I--4e-=2CuI↓+I2,碘遇淀粉变蓝
D.阳极区溶液变蓝的原因是:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝
参考答案:C
本题解析:现用铜片、石墨作电极,电解KI溶液制取CuI。所以,肯定是铜片做阳极,铜片溶解,A 错误;
在阳极铜失去电子得到亚铜离子,和碘离子结合生成CuI白色沉淀,此沉淀是在阳极附近生成,B 错误;
阳极区溶液变蓝的原因是:2Cu+4I--4e-=2CuI↓+I2,碘遇淀粉变蓝,所以,C 正确;D 错误。
本题难度:一般
3、选择题 下列对金属制品采取的防护方法不正确的是( )
A.在电线的外面包上一层塑料层
B.喷涂油漆
C.在海轮的铁制外壳上焊上铜块
D.在轮船的外表面焊上一些锌块
参考答案:A.外面包上一层塑料层可减少与空气中氧气的接触,故A正确;
B.喷涂油漆可以隔绝空气,使金属不受腐蚀,故B正确;
C.原电池能加快化学反应速率,铁铜海水构成原电池,铁做负极加快铁的腐蚀,故C错误;
D.在轮船的外表面焊上一些锌块,铁锌海水形成原电池反应,铁做正极被保护,故D正确;
故选C.
本题解析:
本题难度:一般
4、填空题 (12分)某课外活动小组同学用如图装置进行实验,试回答下列问题。
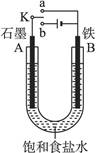
(1)若开始时开关K与a连接,则B极的电极反应式为?。
(2)若开始时开关K与b连接,则其总反应的离子方程式为?。
(3)若用此装置进行电解K2SO4溶液的实验,试回答以下问题:
①开关K应?与连接,
②若标准状况下A极产生2.24 L气体,则溶液中转移?_mol电子
③反应一段时间后,溶液的pH?(填变大、变小或不变),若要电解质溶液复原,
需向溶液中加入的物质为?(填化学式)。
参考答案:(14分)
(1)Fe-2e-====Fe2+?(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)b?0.4mol?③不变? H2O
本题解析:考查原电池、电解池的原理、判断及其应用。
(1)K与a连接则构成原电池,活泼金属作负极,即铁是负极,石墨是正极,因此是铁的吸氧腐蚀,B极的电极反应式为:Fe-2e-====Fe2+。
(2)开关K与b连接,则构成电解池,电解饱和食盐水。石墨和电源正极相连,作阳极,氯离子放电生成氯气。铁和电源负极相连,作阴极,氢离子发生,生成氢气,总反应式为2Cl- + 2H2O  2OH- + H2↑ + Cl2↑。
2OH- + H2↑ + Cl2↑。
(3)①电解池应该有外接电源,所以开关K应与b相连
②电解总方程式为:H2O 2H2+O2↑,当阳极产生氧气2.24 L时,电路中有0.4mol电子的转移;
2H2+O2↑,当阳极产生氧气2.24 L时,电路中有0.4mol电子的转移;
③由于原溶液为中性,电解本质是水的减少,所以电解过程中溶液的pH不变,若要电解质溶液复原,只需向溶液中加适量的水即可。
本题难度:一般
5、选择题 下列叙述的方法不正确的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀
D.用牺牲锌块的方法来保护船身
参考答案:A、因金属的电化学腐蚀比化学腐蚀更常见,故A正确;
B、用铝质铆钉、铁板、来源:91考试网 www.91exAm.org潮湿的空气构成了原电池,铝质铆钉作负极,容易腐蚀,铁板得到保护,故B错误;
C、因钢铁生锈需要氧气、水,在干燥空气中不易被腐蚀,故C正确;
D、锌块、船身(铁)、海水构成了原电池,锌块作负极、容易腐蚀,船身(铁)得到保护,故D正确;
故选:B.
本题解析:
本题难度:一般