1、选择题 下列叙述正确的是
[? ]
A.工业上用电解熔融MgCl2的方法制备镁
B.原电池、电解池是将化学能转化为电能的装置
C.铁船底部镶嵌锌块的目的是锌作原电池正极,保护船体免受腐蚀
D.钢铁被腐蚀的负极反应是:Fe-3e-=Fe3+
参考答案:A
本题解析:
本题难度:简单
2、选择题 为防止轮船船体的腐蚀,应在船壳下水线位置嵌入一定数量的 (? )
A.铜片
B.碳棒
C.锌片
D.银片
参考答案:C
本题解析:略
本题难度:简单
3、选择题 如下图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是(? )
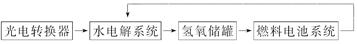 ?
?
向日面时?背日面时
A.该能量转化系统工作时,需不断补充H2O
B.该转化系统的能量本质上来源于太阳能
C.水电解系统中的阴极反应:O2+2H2O+4e-=4OH-
D.燃料电池放电时的负极反应:H2-2e-=2H+
参考答案:B
本题解析:水电解时阴极为2H++2e-=H2↑,C项错误;燃料电池放电时负极为H2+2OH--2e-=2H2O,故D项错误;A项中H2O可以循环利用,错误;B项正确。
本题难度:一般
4、选择题 铜板上铁铆钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀原理如右图所示。下列有关此过程的说法不正确的是
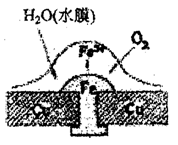
A.正极上的主要电极反应式为;
B.此过程中铜并未被腐蚀
C.电子从Cu流向Fe
D.此过程中还可能涉及到反应: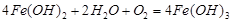
参考答案:C
本题解析:考查金属的电化学腐蚀
A:正确
B:铜作电池的正极,并未发生化学反应,正确
C:电子应从相对活泼的负极铁流出,不正确
D:电化学腐蚀的产物Fe(OH)2可被继续氧化为Fe(OH)3,正确
本题难度:一般
5、选择题 据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中负极主要发生的反应是?
A.2H++2e-=H2↑
B.2H2O+O2+4e-=4OH-
C.Fe-2e-=Fe2+
D.4OH--4e-=2H2O+O2↑
参考答案:C
本题解析:在酸雨季节铁制品极易腐蚀,铁一般作为电池的负极被腐蚀,电解质溶液为酸,所以在其腐蚀中负极主要发生的反应是Fe-2e-=Fe2+,在正极发生的反应为2H++2e-=H2↑,故本题的答案选择C。
点评:本题考查了铁的电化学腐蚀,该考点是高考常考的考点,解答本题的关键是要看电解质溶液,因为酸度较大,所以铁发生的是析氢腐蚀。本题难度适中。
本题难度:简单