1、选择题 下列热化学方程式书写正确的是(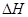 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H="—1367.0" kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水应该是液态稳定,A不正确。中和反应是放热反应,△H小于0,B不正确。D不正确,没有注明状态。所以正确的答案是C。
本题难度:一般
2、填空题 (10分)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入烧杯中,将烧杯放在 滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是?。
(2)写出有关反应的化学方程式??。
(3)实验中观察到的现象有??、?和反应混合物成糊状。
(4)该反应为?(填“吸热”或“放热”)反应,这是由于反应物的总能量?(填“小于”或“大于”)生成物的总能量。
参考答案:(1)搅拌使混合物充分接触并反应(2分)
(2)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3 ↑+10H2O?(2分)
(3)玻璃片上结冰而与小烧杯粘在一起(2分),有少许刺激性气味(2分)
(4),吸热(1分),小于(1分)
本题解析:(1)通过玻璃棒的搅拌,可以使混合物充分接触并反应。
(2)强碱和铵盐反应产生氨气,方程式为Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3 ↑+10H2O。
(3)由于反应是吸热反应,致使周围环境的温度降低,所以会出现结冰现象。同时有少许刺激性气味产生。
(4)反应吸热,说明反应物的总能量低于生成物的总能量。
本题难度:简单
3、选择题 已知在298K、101kPa时,
(1)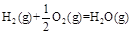 ?
?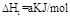 ?(2)
?(2)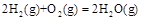

(3)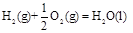 ?
?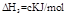 ?(4)
?(4) ?
?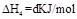
下列关系式中正确的是
A.2a=b<0
B.a<c<0
C.b>d>0
D.2c=d>0
参考答案:A
本题解析:氢气燃烧是放热反应,△H小于0.由于液态水的能量高于气态水的能量,所以氢气燃烧生成液态水放出的热量多,但放热越多,△H越小,所以答案选A。
本题难度:简单
4、简答题 (2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
离子
| H+
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol·L-1
| 未测定
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
?
根据表中数据判断试样的pH=?。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g)?△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:? ?。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是?。
A.Ca(OH) 2? B.Na2CO3? C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g)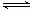 2NO(g)?△H
2NO(g)?△H 0
0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=?。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是?。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为? ?。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H 0,判断该设想能否实现并简述其依据:?。
0,判断该设想能否实现并简述其依据:?。
参考答案:(1)PH=4
(2)①C(s)+H2O(g)=H2(g)+CO(g)?△H=+131.3kJ/mol?②? A? B
(3)①4×10-6,温度越高,反应速率越大?②2XCO+2NOX 2XCO2+N2
2XCO2+N2
③不能实现,因为该反应的△H>0,△S<0,所以△G>0
本题解析:
(1)根据溶液呈电中性的原理可得c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)。将各个数值代入上述式子可得c(H+)=1.0×10-4mol/L,所以pH=4;(2)①?②-①整理可得C(s)+H2O(g)=H2(g)+CO(g)?△H=+131.3kJ/mol;②A.Ca(OH) 2+ SO2=CaSO3↓+H2O;正确。B.Na2CO3+ SO2=Na2SO3+ CO2。正确。C.CaCl2不反应,不能作吸收剂,错误。D.NaHSO3不反应,不能作吸收剂,错误。(3)①在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol;n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol
n(O2)=(0.2-4×10-4)mol; n(NO)= 8×10-4mol.假设气缸的容积为VL。则该温度下的平衡常数 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,是因为升高温度,化学反应速率加快。②根据已知条件结合质量守恒定律可得反应方程式为:2XCO+2NOX
。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,是因为升高温度,化学反应速率加快。②根据已知条件结合质量守恒定律可得反应方程式为:2XCO+2NOX  2XCO2+N2。③由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应。ΔH>0;△S<0,根据体系的自由能ΔG=ΔH-T·ΔS>0,.所以该设想不能实现。
2XCO2+N2。③由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应。ΔH>0;△S<0,根据体系的自由能ΔG=ΔH-T·ΔS>0,.所以该设想不能实现。
本题难度:一般
5、选择题 下列说法正确的是( )
A.反应热就是反应中放出的热量
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
参考答案:C
本题解析:反应热是指在一定条件下,化学反应过程中放出或吸热的能量,也称为反应的焓变,因此选项A不正确;放热时△H<0,吸热时△H>0,所以选项B不正确;反应热还等于反应过程中断键吸收的能量和形成化学键所放出的能量的差值,所以选项D是错误的,因此正确的答案选C。
本题难度:简单