1、填空题 (6分)实验测定某有机物元素质量组成为C:69%,H:4.6%,N:8.0%,其余是O,相对分子质量在300~400之间,则该有机物的实验式为▲_?,相对分子质量为▲_,分子式为▲_。
2、选择题 在标准状况时密度为2.5g/L的是
A.C4H8
B.C2H4
C.C2H2
D.CH4
3、选择题 工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)
A.硝基苯(二氧化氮):加NaOH溶液,分液
B.乙烷(乙烯):催化加氢
C.乙醇(水):加新制生石灰,蒸馏
D.油脂皂化反应产物中分离出高级脂肪酸钠:加NaCl,过滤
4、选择题 将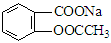 转变为
转变为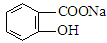 方法为 (? )
方法为 (? )
A.与稀H2SO4共热后,加入足量Na2CO3
B.与稀H2SO4共热后,加入足量NaOH
C.与足量NaOH溶液共热后,再通入CO2
D.与足量NaOH溶液共热后,再加入稀硫酸
5、实验题 已知:苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。乙醚的沸点为34.6℃。实验室常用苯甲醛制备苯甲醇和苯甲酸,其原理为:2C6H5―CHO+NaOH C6H5―CH2OH+C6H5―COONa
C6H5―CH2OH+C6H5―COONa
实验步骤如下:
①向如图所示装置中加入适量 NaOH、水和苯甲醛,混匀、加热,使反应充分进行。

②从冷凝管下口加入冷水,混匀,冷却。倒入分液漏斗,用乙醚萃取、分液。水层保留待用。将乙醚层依次用10%碳酸钠溶液、水洗涤。
③将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇。
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体。冷却、抽滤得粗产品,将粗产品提纯得苯甲酸。
(1)步骤②中,最后用水洗涤的作用是?。将分液漏斗中两层液体分离开的实验操作方法是:先?后?。
(2)步骤③中无水硫酸镁的作用是?。
(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为?;将反应后混合物冷却的目的是?。
(4)抽滤装置所包含的仪器除减压系统外,还有?、?(填仪器名称)。