1、选择题 将VLHCl气体(?标准状况)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为( )
A.
mol/L
B.mol/L
C.mol/L
D.mol/L
参考答案:标准状况下,VLHCl气体的物质的量为n=VL22.4L/mol=V22.4mol,
溶液体积为1000ml=1L,
所以该盐酸的物质的量浓度为c=V22.4mol1L=V22.4mol/L.
故选C.
本题解析:
本题难度:简单
2、选择题 用NA代表阿伏加德罗常数,下列说法正确的是?(?)
A.12g金刚石中所含的共价键数为4NA
B.标准状况下,11.2L SO3所含的氧原子数为1.5NA
C.常温下,1L0.1mol/L的NH4NO3溶液中铵根离子为0.1 NA
D.1mol 过氧化氢分解转移NA电子
参考答案:D
本题解析:A.12g金刚石中所含的共价键数为2NA,A错。B.标准状况下,SO3是固体,不能用气体摩尔体积,B错。C.溶液中铵根离子会水解而小于0.1 NA,C错。1mol 过氧化氢分解转移1mol电子,D对。故选D
本题难度:一般
3、计算题 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少? 生成标况下氢气多少毫升?
参考答案:1.25mol/L;16.1%;2240 ml
本题解析:
本题难度:一般
4、选择题 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为4∶3,则样品中铁、铝物质的量之比为( )
A.3∶2
B.1∶2
C.3∶4
D.4∶3
参考答案:B
本题解析:不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,可以假设只要铁和盐酸反应产生的氢气的量与金属铝和氢氧化钠反应产生的氢气的物质的量分别是1mol和3mol就行了,根据化学方程式可以知道:
Fe~H2,当生成1mol氢气时,消耗金属铁1mol,
2Al~3H2,当生成3mol的氢气时,消耗金属铝的物质的量为2mol,
所以铁与铝的物质的量比为1:3。
故选B.
点评:本题考查混合物的计算,题目难度不大,本题注意从生成氢气的质量相等判断铁与铝的质量关系。
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是(? )
A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA
B.1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA
C.7.8 g Na2O2中含有的阴离子数等于0.1NA
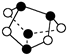
D.0.5 mol雄黄(As4S4,结构如下图)中含有NA个S—S键