| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》考点预测(2019年强化版)(二)
参考答案:CD 本题解析:向22.4gFe2O3、Cu的混合物中加入0.5 mol/L的硫酸溶液750mL,固体完全溶解,发生反应为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe2(SO4)3+Cu=2FeSO4+CuSO4,若二者恰好完全反应,则在原混合物中成分的物质的量关系是Fe2O3~Cu,即160g Fe2O3产生的离子与64gCu恰好完全反应,总质量是224g,现在总质量是22.4g,所以其中含有Cu的质量6.4g;若硫酸与Fe2O3发生反应完全变为Fe2(SO4)3,则根据S守恒可得n(Fe2O3)=n(H2SO4)÷3="(0.5" mol/L×0.75L)÷3="0.125" mol,m(Fe2O3)=" 0.125" mol×160g/mol=20g,所以其中含有Cu的质量是22.4g-20g=2.4g;因此在原混合物中含有Cu的质量在2.4g~6.4g范围,故选项是CD。 本题难度:一般 3、选择题 下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl- 物质的量浓度相同的是 |
参考答案:D
本题解析:离子的浓度与溶液的体积无关,100 mL 0.5 mol/L NaCl溶液所含的Cl- 物质的量浓度是0.5 mol/L,0.5 mol/L MgCl2溶液Cl- 物质的量浓度是1 mol/L,0.25 mol/L AlCl3溶液Cl- 物质的量浓度,0.75 mol/L,1 mol/L NaCl溶液Cl- 物质的量浓度是1 mol/L,0.5 mol/L HCl溶液Cl- 物质的量浓度是0.5 mol/L,选D。
考点:物质的量浓度的理解和简单的计算。
本题难度:一般
4、选择题 4 mL O2和3 mL NxHy(y>x)的混合气体在120 ℃、1.01×105 Pa条件下充分反应,恢复到原来的温度和压强时,测得混合气体(N2、O2、H2O)的密度比原来减少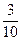 。
。
(1)写出其反应的化学方程式。
(2)推算NxHy的化学式。
参考答案:(1)4NxHy+yO2====2xN2+2yH2O? (2)N2H4
本题解析:由密度比原来减少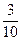 推出反应前后气体的物质的量之比为7∶10。该反应的化学方程式为4NxHy+yO2====2xN2+2yH2O,再根据差量法求出关系式为:2x+y=8,经讨论,合理解为x=2,y=4。
推出反应前后气体的物质的量之比为7∶10。该反应的化学方程式为4NxHy+yO2====2xN2+2yH2O,再根据差量法求出关系式为:2x+y=8,经讨论,合理解为x=2,y=4。
本题难度:简单
5、选择题 溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为 (?)
A.1∶2
B.1∶4
C.3∶4
D.3∶2
参考答案:A
本题解析:根据溶液呈电中性可知:1×n(Na+)+3×n(Al3+)=1×n(Cl-)+2×n(SO42-). n(SO42-)=(1×3+3×2-1×1)÷2=4.所以n(Al3+):n(SO42-)=2:4-1:2.所以选项为A。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《离子共存》.. | |