| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》考点预测(2019年强化版)(三)
3、选择题 配制物质的量浓度的溶液,造成浓度偏高的操作是( ) 4、填空题 在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。 5、选择题 下列物质中所含原子数与0.1 mol H3PO4所含原子数相等的是 ( ) |
1、选择题 人造空气(氧气O2与氦气He的混合气)可用于减轻某些病痛或供深水潜水员使用。在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的质量比是? (? )
A.1:1
B.1∶4
C.2:1
D.2:3
参考答案:C
本题解析:5.6L“人造空气”的质量是2.4g,则22.4L人造空气的质量为2.4×4=9.6g;即混合气体的平均相对分子质量为9.6;利用“十字交叉”法得:物质的量的关系为: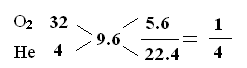
所以可求得氧气与氦气的质量比是2:1
本题难度:一般
2、选择题 0.5mol氢气在标准状况下所占的体积约是( )
A.22.4L
B.11.2L
C.5.6L
D.2.24L
参考答案:B
本题解析:标准状况下,气体的摩尔体积是22.4L/mol,所以根据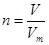 可知,0.5mol氢气在标准状况下所占的体积0.5mol×22.4L/mol=11.2L,答案选B。
可知,0.5mol氢气在标准状况下所占的体积0.5mol×22.4L/mol=11.2L,答案选B。
本题难度:一般
3、选择题 配制物质的量浓度的溶液,造成浓度偏高的操作是( )
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
参考答案:A、定容时,滴加蒸馏水超过刻度线,溶液的体积偏大,浓度偏小,故A错误;
B、定容时,眼睛俯视刻度线,溶液的液面未达到刻度线,溶液的体积偏小,浓度偏大,故B正确;
C、洗涤烧杯和玻璃棒的溶液未转入容量瓶中,洗涤液中含有杂质,溶质的质量偏小,浓度偏小,故C错误;
D、定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,故D正确;
故选:B.
本题解析:
本题难度:一般
4、填空题 在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问: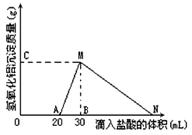
(1)此溶液中同时含有____mol___ 离子;
(2) C(或M)点的纵坐标为0.78,则c(AlO2-)为
(3) 点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL
参考答案:(6分) (1)此溶液中同时含有_ 0.02 mol OH- 离子;
(2) c(AlO2-)为 1mol/L
(3)体积为 60 mL
本题解析:(1)由图可知,滴加盐酸开始不产生沉淀,故溶液中还含有OH-,开始加入的20mL盐酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)=n(H+)=0.02L×1mol/L=0.02mol,
故答案为:0.02;OH-;
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)由图可知,从20mL~40mL发生的反应为AlO2-+H++H2O
本题难度:困难
5、选择题 下列物质中所含原子数与0.1 mol H3PO4所含原子数相等的是 ( )
A.0.4 mol H2O
B.0.2 mol H2SO4
C.0.4 mol HCl
D.0.3 mol HNO3
参考答案:C.
本题解析:因为同一种微粒的个数之比等于其物质的量之比,所以分别求出各种物质中所含的原子的物质的量即可。如下表所示:
物质
物质的量
分子中的
原子数
所含原子的
物质的量
H3PO4
0.1 mol
8
0.8 mol
H2O
0.4 mol
3
1.2 mol
H2SO4
0.2 mol
7
1.4 mol
HCl
0.4 mol
2
0.8 mol
HNO3
0.3 mol
5
1.5 mol
考点:物质的量的计算、阿伏伽德罗常数的意义
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《离子共存》.. | |