1、填空题 (2014届上海市十三校高三测试化学试卷)
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
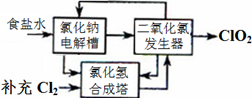
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
参考答案:
(1)H2、Cl2?2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)同时产生了大量的氯气,不仅产率低, 而且产品难以分离,同时很有可能造成环境污染;能耗较大等
(3)1C6H12O6+24NaClO3+12H2SO4→24ClO2↑+6CO2↑+18H2O+12Na2SO4,? 0.16NA,
(4)2.5
(5)SO32- +H2O OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O OH-+H2SO3;Na+? SO32-?OH-?HSO3-?H +
OH-+H2SO3;Na+? SO32-?OH-?HSO3-?H +
(6)NaHSO3、Na2SO3、 NaCl、或(NaHSO3、Na2SO3、 NaCl、SO2、H2SO3)
本题解析:
(1)有工艺流程图可以看出:在该工艺中可利用的单质有H2、Cl2?。根据流程图、质量守恒定律及电子守恒规律可得出在发生器中生成ClO2的化学方程式为: 2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)由 制备原理和流程图可知此法的缺点主要是会产生大量的Cl2,消耗大量的电能,产物ClO2和Cl2不仅不容易分离,而且物质利用率低,很容易造成大气污染。
(3)纤维素水解得到的最终产物X是葡萄糖C6H12O6。它与NaClO3在酸性条件下发生反应,根据质量守恒定律和电子守恒的知识可得方程式为1C6H12O6+24NaClO3+12H2SO 4→24ClO2↑+6CO2↑ +18H2O+ 12Na2SO4,由方程式可以看出每产生30mol的气体,转移电子24NA。现在产生气体颚物质的量为4.48L ÷22.4L/mol=0.2mol。所以转移电子的物质的量为24NA÷30×0.2="0.16" NA
(4)处理含CN—相同量的电镀废水,即转移电子的物质的量相同。假设转移电子2mol,则需要Cl2的物质的量是1mol;需要ClO2的物质的量为2÷=0.4mol。所以n(Cl2): n(ClO2)=1:0.4=2.5。
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O
H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O  OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O  OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。
OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。
(6)在Na2SO3溶液中滴加稀盐酸若恰好发生反应:Na2SO3+HCl=NaCl+NaHSO3。则由于NaHSO3溶液呈酸性。所以至中性时,n(HCl)<n(Na2SO3).产生溶液中含有的溶质有未反应的Na2SO3及反应生成的NaCl、NaHSO3。溶质有Na2SO3、NaCl、NaHSO3。也可能滴加HCl局部过量会产生SO2、H2SO3溶解在该溶液中还含有SO2和H2SO3。
本题难度:一般
2、实验题 主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。
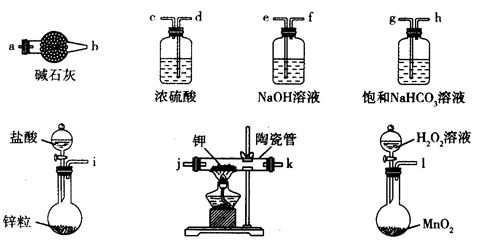
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:

根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。
参考答案:(1)lefdejka(jk可互换) (2分)
(2)检测装置的气密性(2分)
(3)1.75(2分)
(4)4KO2+2CO2=2K2CO3+3O2(2分)相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。(2分)
本题解析:(1)根据超氧化钾(KO2),容易与空气中的水、二氧化碳等发生反应,因此制备的过程中一定要把装置所含的水和二氧化碳除去,进入到陶瓷管中的气体应先经过氢氧化钠溶液除二氧化碳,再经过浓硫酸干燥,陶瓷管后面也要接一个装有碱石灰的干燥管,防空气中的水和二氧化碳与超氧化钾接触,故顺序为:lefdejka(jk可互换);(2) 第一步应为检查装置的气密性;(3)钾的物质的量为:(15.19-14.80)/39=0.01mol,氧的物质的量=(15.47-5.19)/16=0.175mol,所以X=0.175mol/0.01mol=1.75;(4)过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2NaCO3+O2,KO2与CO2反应的方程式为4KO2+2CO2=2K2CO3+3O2,故其优点是相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。
本题难度:一般
3、实验题 (16分)欲用98 %的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:
%的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:
A.用量筒量取浓硫酸?
B.反复上下颠倒摇匀
C.加蒸馏水至刻度线下1~2cm时改用胶头滴管加水至刻度线
D.洗净所用仪器?
E.稀释浓硫酸
F.将稀释后并冷却的硫酸溶液注入容量瓶
G.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也注入容量瓶?
(1)其操作正确的顺序为(填编号):?。
① D A E F G B C?② D A E F G C B?③ D A F E G B C
(2)简要回答下列问题:
①所需浓硫酸的体积为??mL(小数点后保留一位)。现有10mL 、15mL、20mL、50mL四种量筒,应选用?mL的量筒最好。
②洗涤烧杯2~3次,洗涤液也要转入容量瓶,否则会使结果浓度?。(填偏高,偏低或无影响)
③稀释后并冷却的硫酸用?注入?中。
④加蒸馏水定容时必须使溶液凹液面与容量瓶刻度线相切,如果不小心将水加过刻度线应? ?。
?。
(3)下列实验操作,造成溶液浓度偏低的是?。
A.容量瓶用蒸馏水洗净后未经干燥处理
B.转移过程中有少量溶液溅出
C.稀释后的硫酸没有冷却到室温就转移到容量瓶中并加水定容
D.定容时,俯视容量瓶的刻度线
E.摇匀后发现液面低于刻度线,再用胶头滴管加水至刻度线
参考答案:(16分)?
(1) ②
(2) ①? 13.6? 15 ②?偏低③玻璃棒引流? 500mL容量瓶 (不写容积扣1分)④?重新配制
(3)BE
本题解析:略
本题难度:简单
4、选择题 实验室可用如图所示装置干燥、收集气体R,则R可能是( )
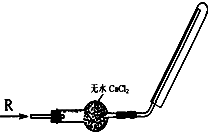
A.NO
B.NO2
C.H2
D.Cl2
参考答案:A.NO的分子量和空气的平均分子量相差不大,故不能用排气法收集,故A错误;
B.NO2分子量为46,比空气的平均分子量29大,应该用向上排气法收集,故B错误;
C.H2的分子量为2,密度小于空气的密度,用向下排气法收集,故C正确;
D.Cl2的分子量为71,密度大于空气密度,应该用向上排气法收集,故D错误;
故选C.
本题解析:
本题难度:简单
5、实验题 (2分)下列实验操作或对实验事实的描述中正确的说法有?。
①如果苯酚浓溶液沾到皮肤上,应立即用酒精洗涤
②除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③实验室制硝基苯:向浓硝酸、浓硫酸的混合酸中滴入苯,在50~60℃的水浴中加热
④实验室制取乙烯时,将无水乙醇和10mol·L-1 H2SO4混合加热到1700C,可制得乙烯
⑤只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑥检验卤代烃中的卤离子,是将试样放入试管,然后加入NaOH煮沸,随即加入硝酸银即可。
参考答案:(2分)①③⑤
本题解析:②错,除去甲烷中混有的少量乙烯,可以让混合物通过盛有溴水溶液的洗气装置
④错,实验室制取乙烯时,将无水乙醇和18.4mol·L-1 H2SO4混合加热到1700C,可制得乙烯
⑥错,检验卤代烃中的卤离子,是将试样放入试管,然后加入NaOH煮沸,再加入过量的稀硝酸西化,随即加入硝酸银即可。
本题难度:一般