1、选择题 物质的量浓度相同时,下列既能跟NaOH溶液反应又能跟盐酸反应的溶液中,pH最大的是
[? ]
A.Na2CO3溶液
B.NH4HCO3溶液
C.NaHCO3溶液
D.NaHSO4溶液
参考答案:C
本题解析:
本题难度:一般
2、选择题 向体积为Va 的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
[? ]
A. Va>Vb时:c(CH3COOH) +c(CH3COO-)>c(K+)
B. Va与Vb任意比时:c(K+)+ c(H+)=c(OH-)+ c(CH3COO-)
C. Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D. Va=Vb时:c(CH3COOH)+c(H+)= c(OH-)
参考答案:C
本题解析:
本题难度:一般
3、填空题 回答下列各小题:
(1)已知 在水中的电离方程式为
在水中的电离方程式为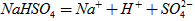 。在
。在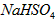 溶液
溶液
__________ (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
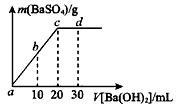
(2)常温下,向1.0mol/L的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”),c点所示的离子方程式为___________________。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”),c点所示的离子方程式为___________________。
(3)在T℃时,将 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将
__________25℃(填“高于”或“低于”),Kw为________,在该溶液中由水电离出的 为
为
_________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的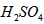 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为_________________________。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为_________________________。
(4)0.1 mol·L-1pH为4的NaHB溶液中 由大到小的顺序为
由大到小的顺序为
_______________。
(5)在0.1 mol·L-1的① 溶液、②
溶液、②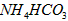 溶液、③
溶液、③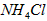 溶液中,
溶液中, 由大到小的排列顺序为_____________________。
由大到小的排列顺序为_____________________。
参考答案:(1)=
(2)中性;
(3)高于;10-12;10-10;9:11;
(4)②>③>①
(5)①>③>④>②
本题解析:
本题难度:困难
4、选择题 下列溶液中微粒的物质的量浓度关系正确的是( )
A.氯水中:c(Cl2)═2[c(ClO-)+c(Cl-)+c(HClO)]
B.Na2CO3溶液:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)
D.室温下,向0.01?mol?L-1?NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
参考答案:A.由于氯气部分和水反应,溶液中存在氯气分子,不能确定反应的量的关系,故A错误;
B.Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒:c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)],二者联式可得
c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3),故B错误;
C.根据物料守恒,应存在c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-),故C错误;
D.向0.01mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性,溶液中应存在NH4+和NH3?H2O,则c(SO42-)>c(NH4+),溶液呈中性,则c(OH-)=c(H+),故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 (1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:______
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是______
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池.若a?b相连,a为负极;c?d相连,c为负极;a?c相连,c为正极;b?d相连,b为正极,则四种金属的活动性由强到弱顺序为:______
(4)写出Na2CO3溶于水后的电离方程式:______
(5)写出氯化铁溶液水解反应的离子方程式______.
参考答案:(1)因pH越大,说明酸根离子水解越是强烈,对应的酸越弱.所以HX、HY、HZ的酸性由强到弱的顺序:HX>HY>HZ,故答案为:HX>HY>HZ;
(2)AlCl3是强酸弱碱盐,能水解生成氢氧化铝和氯化氢,AlCl3+3H2O?Al(OH)3+3HCl,HCl具有挥发性,所以在加热蒸发、蒸干,灼烧过程中挥发消失;灼烧Al(OH)3,Al(OH)3能分解生成氧化铝和水2Al(OH)3?加热?.?Al2O3+3H2O,水在加热过程中蒸发掉,所以最后得到的白色固体是Al2O3,故答案为:Al2O3;
(3)若a.b相连时,a为溶解,则a为负极,活动性a>b;c.d相连时c为负极,活动性c>d;a.c相连时c为正极,a为负极,活动性a>c;b.d相连时b为正极,d为负极,活动性d>b;则有活动性a>c>d>b,
故答案为:a>c>d>b;
(4)碳酸钠属于强电解质,溶于水后能完全电离:Na2CO3=2Na++CO32-,故答案为:Na2CO3=2Na++CO32-;
(5)三价铁离子的水解原理为:Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+.
本题解析:
本题难度:一般