1、选择题 下列各组微粒中,核外电子总数相等的是
A.Na+和Li+
B.H2O和H3O+
C.CO和CO2
D.NO和CO
参考答案:B
本题解析:A中前者是10个,后者是2个电子;B中都是10电子微粒的;C中前者是14个电子,后者是22个电子;D中前者是15个电子,后者是14电子,答案选B。
点评:计算微粒的电子数时,需要视情况讨论。如果是中性的,则电子数等于质子数。如果是阳离子,则电子数等于质子数减去所带电荷数。如果是阴离子,则电子数等于质子数加上所带电荷数,据此可以进行有关计算。
本题难度:一般
2、选择题 已知短周期元素R、W、X、Y、Z的原子序数依次增大,其氢化物中上述元素的化合价如下表,下列说法正确的是(? )
?
A.离子还原性:Y2->Z-
B.离子半径W+>Z-
C.气态氢化物稳定性:RH4<XH4
D.酸性:H2YO4<HZO4
参考答案:AD
本题解析: R、W、X、Y、Z是原子序数依次增大的5个短周期元素,从化合价可以判断出它们分别是C、Na、Si、S、Cl。根据元素位置和元素周期律可得离子还原性S2->Cl- ,A正确;离子半径Na +<Cl - ,B错误;C比Si非金属性更强,所以氢化物稳定性CH4>SiH4 ,C错误;Cl比S非金属性更强,所以最高价氧化物对应水化物的酸性H2SO4<HClO4 ,D正确;故选AD。
本题难度:一般
3、选择题 X、Y元素均为主族元素, 和
和 的电子层结构相同,则下列说法中不正确的是
的电子层结构相同,则下列说法中不正确的是
A.Y元素的核电荷数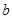 等于
等于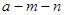
B.Y的原子序数小于X的原子序数
C. 的离子半径小于
的离子半径小于 的离子半径
的离子半径
D.若X元素位于 周期,则Y元素位于
周期,则Y元素位于 周期
周期
参考答案:C
本题解析:可以把X、Y元素分别设想为铝: 和氧:
和氧: 即可很快类似问题。
即可很快类似问题。
本题难度:一般
4、选择题 下列说法中正确的是(?)
A.随原子序数的递增,第三周期元素的电负性逐渐减小
B.铝的第一电离能比镁的第一电离能大
C.在所有的元素中,氟的第一电离能最大
D.在所有的元素中,氟的电负性最大
参考答案:D
本题解析:非金属性越强,电负性越大。同周期自左向右非金属性逐渐增强,所以选项A不正确。镁原子中3s电子处于全充满状态,稳定性强,所以第一电离能大于铝的,B不正确。C不正确,应该是稀有气体元素的,因此答案选D。
本题难度:一般
5、选择题 不同元素的原子间最本质的区别是
A.中子数不同
B.相对原子质量不同
C.质子数不同
D.最外层电子数不同
参考答案:C
本题解析:元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),所以不同元素原子之间的本质区别是质子数(即核电荷数)不同。故选项C正确。
本题难度:简单