1、选择题 下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池的电极不一定参与电极反应
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
参考答案:A、电极材料可由金属构成,也可由能导电的非金属和金属材料构成;故A错误;
B、原电池电极可以参加反应,也可以不参加反应,如燃料电池,故B正确;
C、原电池在在工作时其负极不断产生电子并经外电路流向正极,电子流出的一极为负极,失电子发生氧化反应,故C错误;
D、原电池放电,电流从正极流向负极,故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 汽车的启动电源常用铅蓄电池,充电和放电反应按下式进行:
PbO2+Pb+2H2SO4 2PbSO4+2H2O,由此可知,该电池放电时的负极是
2PbSO4+2H2O,由此可知,该电池放电时的负极是
A.PbO2
B.Pb
C.H2SO4
D.PbSO4
参考答案:B
本题解析:原电池负极失去电子,正极得到电子。放电相当于原电池,所以根据总反应式可知,放电时铅失去电子,所以铅是负极,二氧化铅是正极,答案选B。
本题难度:一般
3、填空题 (14分)目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极。在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流。
(1)水煤气成分是 。水煤气又称为合成气,在一定条件下可以合成二甲基醚时,还产生一种可以参与大气循环的无机化合物,写出该化学方程式可能是 。
(2)若以水煤气为上述陶瓷电池的燃料气,则电池的负极反应方程式为 。
(3)下图是丙烷、二甲醚燃烧过程中能量变化图,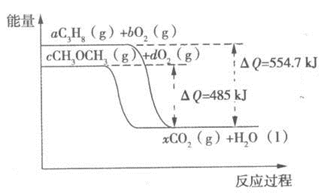
其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式
若以第⑵问中陶瓷电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有 10.8g银析出,试求制备水煤气时, 至少需要碳 g
参考答案:(1)CO、H2(2分)
(2)3CO + 3H2 = CH3OCH3 + CO2 或 2CO+4H2 = CH3OCH3 + H2O (2分)
(3)CO+O2--2e—=CO2 (2分) 2 H2+O2—2e-=2H2O (2分)
(4)CH3OCH3(g)+3O2(g) → 2CO2(g)+3H2O(l); △H=-1455kJ·mol-1 (3分)
(5)0.3 (3分)
本题解析:略
本题难度:一般
4、填空题 (12分)欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O?
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
?物质
n/mol
T/℃
| 活性炭
| NO
| E
| F
|
初始
| 2.030
| 0.100
| 0
| 0
|
T1
| 2.000
| 0.040
| 0.030
| 0.030
|
T2
| 2.005
| 0.050
| 0.025
| 0.025
|
①请结合上表数据,写出NO与活性炭反应的化学方程式?。
②根据上述信息判断,温度T1和T2的关系是(填序号)?。
a.T1>T2? b.T1<T2? c.无法比较
(3)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml? 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:?
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质, CO 为阳极燃气,空气与 CO2的混和气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO + 2CO32- =4CO2 +4e-则阴极反应式:??,电池总反应式:?。
参考答案:(12分)(1)5、4、6、5、4、2、6(2分)
(2)①C+2NO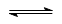 N2+CO2(2分)②c?(2分)?
N2+CO2(2分)②c?(2分)?
(3)c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(2分)
(4)O2 ?+ 2CO2?+4e- ?="2" CO32-(2分) , 2CO+ O2 = 2CO2(2分)
本题解析:】(1)考查氧化还原反应方程式的配平,配平的依据是电子的得失守恒。碳是还原剂,化合价升高4个单位。KMnO4是氧化剂,锰元素的化合价降低5铬单位,所以1mol氧化剂得到5mol电子,即氧化剂和还原剂的物质的量之比是4︰5,所以方程式为3C + 2K2Cr2O7 +8H2SO4 = 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 +8H2O
(2)①?C? +? NO ?E↑?+? F↑
?E↑?+? F↑
初n:? 2.030? 0.100? 0? 0
⊿n: 0.030? 0.060? 0.030? 0.030
T1 n:? 2.000? 0.040? 0.030? 0.030
由各物质的⊿n及原子守恒,可知化学方程式为:C+2NO N2 +CO2
N2 +CO2
②根据上述信息无法判断温度T1和T2的关系,因为上述可逆反应正反应是吸热还是放热反应并不知道
(3)由题意知:3NaOH+2CO2=Na2CO3 + NaHCO3 + H2O
由于Na2CO3水解较NaHCO3强,所以c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
(4)电池的总反应为:2CO+ O2 = 2CO2,减去阳极反应式:2CO + 2CO32- =4CO2 +4e-即可得到阴极反应式:O2 ?+ 2CO2?+4e- ?="2" CO32-
本题难度:一般
5、选择题 原电池的正极一定是(?)
A.电子流出的极
B.电子流入的极
C.发生氧化反应的极
D.电极自身参与反应的极
参考答案:B
本题解析:略
本题难度:简单