1、填空题 (16分)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
⑴工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为?。
⑵当氨碳比 =4时,CO2的转化率随时间的变化关系如右图所示。
=4时,CO2的转化率随时间的变化关系如右图所示。
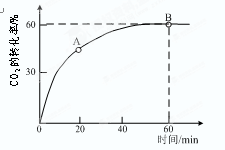
①A点的逆反应速率v逆(CO2)?B点的正反应速率v正(CO2)(填 “大于”、“小于”或“等于”)
②NH3的平衡转化率为?。
⑶人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如右图。

①电源的负极为?(填“A”或“B”)。
②阳极室中发生的反应依次为?、?。
③电解结束后,阴极室溶液的pH与电解前相比将?;若两极共收集到气体13.44 L(标准状况),则除去的尿素为?g(忽略气体的溶解)。
参考答案:(1)2NH3+CO2 CO(NH2)2+H2O (2)①小于? ②30%
CO(NH2)2+H2O (2)①小于? ②30%
(3)①B? ②2Cl--2e-=Cl2↑?CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl?③不变? 7.2
本题解析:(1)根据反应物和生成物可知,反应的方程式是2NH3+CO2 CO(NH2)2+H2O。
CO(NH2)2+H2O。
(2)①根据图像可知,B点CO2的转化率不再发生变化,所以是平衡状态。因此A点没有达到平衡状态,因此A点的逆反应速率小于B的点的正反应速率;如果设CO2的物质的量是1mol,则氨气是4mol。根据图像可知,CO2的转化率是0.6,则消耗CO2是0.6mol,所以消耗氨气是1.2mol,因此氨气的转化率是1.2÷4=0.3,即30%。
(3)①根据装置图可知,和电源B极相连的产生氢气,所以该电极是阴极,氢离子放电,所以B是电源的负极,A是正极。
②阳极失去电子,所以溶液中的氯离子放电,生成氯气。氯气具有氧化性,能氧化尿素生成氮气和CO2,方程式分别是2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。
本题难度:一般
2、推断题 阅读下列A、B、C、D、E、F六种短周期元素的相关信息。
①含A的物质焰色反应为黄色。
②B的原子最外层电子数是其内层电子数的3倍。
③C的最简单离子与Ne原子的电子数相同,且在具有相同电子数的简单离子中离子半径最小。
④D与B处于同主族。
⑤目前人类已知的物质(包括人工制造的物质)中,大多数都含有E元素。
⑥F元素的某种原子中只有质子,没有中子。
请根据上述信息回答下列问题:
(1)由已知六种元素中的三种组成的易溶于水的物质中,能促进水电离的物质是_____________(写出一种物质的化学式,下同),能抑制水电离的物质是____________。
(2)海水电源主要用于海上航标灯及相类似的海上用电设施,电源利用海水作电解液,空气中的氧作阴极活性物,C的单质作为阳极。写出这种海水电源的正极反应式:________________。
(3)常温下,向体积为1.5 L、浓度为0.1 mol/L的A 的最高价氧化物对应水化物的水溶液中通入2. 24L(标准状况)EB2气体,待反应充分后,溶液中各离子浓度由大到小的顺序是_________________。
(4)常温下,向c(H+) =1mol/L,c(Al3+)=c(Fe3+)= 0. 04 mol/L的溶液中加入A的最高价氧化物对应水化物的溶液,以调节溶液的pH(假设溶液体积不变)。那么最先析出的沉淀是___________(填写化学式),刚刚析出沉淀时溶液的pH=________。(已知Kap[Al(OH)3]=1.3×10-33mol4/L4,Ksp[Fe(OH)3]=2.6×10-39
mol4/L4)
参考答案:(1)Al2(SO4)3(或NaAlO2、Na2CO3、Na2SO3、NaHS等);H2SO4(或H2SO3、H2CO3、NaOH等)
(2)2H2O+O2+4e-=4OH-
(3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(4)Fe(OH)3;1.6
本题解析:
本题难度:困难
3、选择题 某化学兴趣小组将锌片和铜片出入番茄中制成水果电池(如图)( )
A.一段时间后,锌片质量会变小
B.铜片上发生氧化反应
C.电子由铜片通过导线流向锌
D.锌电极是该电池的正极
