1、选择题 为除去括号内的杂质,所选用的试剂或方法不?正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.CO2气体(CO),通入O2点燃
参考答案:A、碳酸氢钠可以和氢氧化钠发生反应生成碳酸钠和水,符合除杂的原则,故A正确;
B、向碳酸钠中通入二氧化碳可以发生反应生成碳酸氢钠,符合除杂原则,故B正确;
C、氧化钠在氧气中加热会转化为过氧化钠,符合除杂原则,故C正确;
D、一氧化碳可以和氧气反应生成二氧化碳,但是这样会在二氧化碳中引入杂质氧气,故D错误.
故选D.
本题解析:
本题难度:一般
2、选择题 下列实验设计能够成功的是
?
| 实验目的
| 实验步骤及现象
|
A
| 检验亚硫酸钠试样是否变质
| 
|
B
| 检验某卤代烃是否是氯代烃
| 
|
C
| 证明酸性条件H2O2氧化性比I2强
| 
|
D
| 除去铁屑表面的油污
| 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净
|
?
参考答案:D
本题解析:A.无法达到实验目的,硝酸可把亚硫酸根离子氧化,错误;B.用硝酸代替硫酸,因为硫酸银也是白色的,错误;C.不应加入HNO3,因为它可以把I-氧化,无法比较H2O2和I2谁的氧化性强,
错误;D.碳酸钠溶液在热的条件下,可以水解为氢氧化钠,油污在氢氧化钠作用下水解,而铁屑和氢氧
化钠不反应。
本题难度:一般
3、实验题 现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:
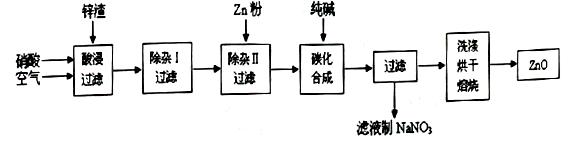
有关氢氧化物完全沉淀的pH见下表:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
pH
| 5.2
| 3.2
| 9.7
| 6.7
| 8.0
|
?
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取?措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有?。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是?。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有?。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式?。
(5)从滤液中提取NaNO3晶体的操作步骤为?。
(6)在实验室如何洗涤过滤出的碱式碳酸锌??。
参考答案:(16分)
(1)加热、搅拌(2分)
(2)烧杯、玻璃棒、漏斗?(3分)
(3)使Fe3+转化为Fe(OH)3沉淀除去(2分)
Al(OH)3、Cu、Zn?(2分)?(不填Zn不扣分)
(4)2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑(2分)
(5)蒸发浓缩、冷却结晶、过滤(3分)
(6)往漏斗中加入少量蒸馏水,浸没沉淀,让其自然滤出,反复几次(2分)
本题解析:(1)增大反应物浓度、升高温度、增大压强(有气体参加的反应)、增大固体表面积、使用合适的催化剂、研磨、搅拌、振荡等措施,都是加快反应速率、提高浸出率的常用措施;(2)过滤分离固液混合物,常用的玻璃仪器有烧杯、普通漏斗、玻璃棒;(3)硝酸具有强氧化性和强酸性,酸性条件下空气中的氧气也能将亚铁离子氧化为铁离子,则溶液中含有Zn2+、Fe3+、Cu2+、Al3+、H+、NO3-,读表中信息可知,将溶液pH调至4时,铁离子完全变为氢氧化铁沉淀,可以除去溶液中的铁离子;将溶液pH调至6时,铝离子完全变为氢氧化铝沉淀,可以除去溶液中的铝离子,由于锌比铜活泼,则加入过量的锌不仅能消耗氢离子,而且能将铜离子完全还原为单质铜,既除去杂质,又没有引入新杂质,则除杂II所得滤渣主要成分为氢氧化铝、铜、锌;(4)依题意,加入的碳酸钠与硝酸锌溶液反应,生成碱式碳酸、二氧化碳,根据质量守恒原理可得该复分解反应方程式:2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑;(5)硝酸钠是可溶性盐,溶解度随温度下降而明显减小,根据其性质推断,将滤液蒸发浓缩、冷却结晶、过滤得到硝酸钠晶体;(6)根据过滤之后洗涤沉淀的一般原理,洗涤碱式碳酸锌时,先向漏斗中加入少量蒸馏水,浸没沉淀,再让其自然滤出,反复几次即可。
本题难度:一般
4、选择题 下列说法中正确的是
A.摩尔既是物质的数量单位又是物质的质量单位
B.物质的量是国际单位制中七个基本单位之一
C.阿伏加德罗常数是12 kg12C中含有的碳原子数目
D.1 molH2O中含有2 molH和1 molO
参考答案:D
本题解析:A项错误,摩尔仅是物质的量的单位而不是质量的单位;B项错误,物质的量是国际单位制中七个基本物理量之一而不是单位;C项错误,阿伏加德罗常数是以12 g12C中含有的碳原子数目而不是12 kg12C中含有的碳原子数目;D项正确.
本题难度:简单
5、填空题 下列表中括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,将所选的试剂及装置的编号填入表中,
试剂:a水,b氢氧化钠溶液,c食盐,d溴水,e新制生石灰,f溴的四氯化碳溶液,g饱和碳酸钠溶液
分离装置:A分液装置,B过滤装置,C蒸馏装置,D洗气装置

参考答案:
本题解析:
本题难度:一般