1、选择题 某金属的硝酸盐受热分解时,生成NO2和O2的物质的量之比是2∶1,则在分解过程中金属元素的化合价是(?)
A.升高
B.降低
C.不变
D.无法确定
参考答案:B
本题解析:根据元素化合价的变化可知,NO2是还原产物,氧气是氧化产物。生成1mol氧气转移4mol电子,而生成2molNO2转移2mol电子,所以根据电子的得失守恒可知,金属元素的化合价一定是降低的,答案选B。
本题难度:简单
2、填空题 在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知E溶液是无色的,请回 答:
答:
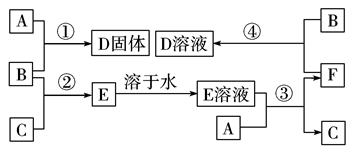
(1)写出下列物质的化学式:
A____________,B____________,C____________。
(2)反应①的化学方程式为: ??。
(3)反应③的化学方程式为: ??。
(4)反应④的离子方程式为: ??。
参考答案: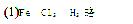
本题解析:略
本题难度:简单
3、填空题 已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
参考答案:(共8分)(1)H 、S(各1分) (2)1mol (3)2mol 、64g(每空2分)
本题解析:(1)反应①中硫酸中氢元素的化合价解得,所以H元素被还原,反应②中硫酸中S元素的化合价降低,所以S元素被还原。
(2)2g氢气的物质的量是1mol,则消耗稀硫酸的物质的量是1mol。
(3)硫酸中S元素的化合价从+6价降低到+4价,得到2个电子,所以反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为2mol。若有4mol H2SO4参加反应时,被还原的硫酸是2mol,所以被还原元素的质量是2mol×32g/mol=64g。
考点:考查氧化还原反应的有关判断、应用以及计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练。有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力。该题的关键是明确氧化还原反应有关概念,准确标出有关元素的化合价变化情况,然后根据电子得失守恒并结合题意灵活运用即可。
本题难度:一般
4、选择题 下列说法正确的是
A.试管具有能溶解固体、配制溶液、加热较多试剂三种用途
B.已知1mol NaHSO4能电离出1mol H+,从而可知NaHSO4属于强酸
C.若:A酸溶液中C(H+) > B酸溶液中C(H+),则酸性:A酸 > B酸
D.蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的支管口
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列有机化学方程式书写正确的( )
A.CH4+Cl2
CH2Cl2+H2
B.H2C=CH2+Br2→CH3CHBr2
C.CH3CH2OH+CH3COOHCH3COOCH2CH3
D.2CH3CH2OH+O22CH3CHO+2H2O
参考答案:D
本题解析:
本题难度:一般