1、选择题 下列有关化学用语的表达正确的是
A.次氯酸电子式: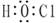
B.含1个中子的氢原子: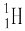
C.Cl结构示意图: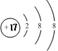
D.苯甲醛的结构简式: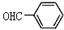
参考答案:D
本题解析:次氯酸中氯原子还有没有参与成键的电子,电子式为 。含1个中子的氢原子,其质量数是2,应该为
。含1个中子的氢原子,其质量数是2,应该为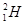 。氯原子的最外层有7个电子,应该是
。氯原子的最外层有7个电子,应该是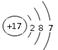 。答案选D。
。答案选D。
本题难度:一般
2、填空题 尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
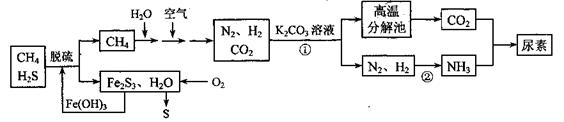
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要?CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________
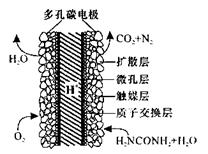
参考答案:(14分)
(1)CO32-+CO2+H2O=2HCO3-(2分)
(2)2Fe2S3+6H2O+3O2=4Fe(OH)3+6S(2分)
(3)减小(2分)? sp2(2分)?(4)4.48×104(3分)
(5)CO(NH2)2+H2O-6e-= N2↑+CO2↑+6H+(3分)
本题解析:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾,其离子反应为CO32-+CO2+H2O═2HCO3-;(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小;H2NCOONH4中的C原子上没有孤对电子,成键数为3,C原子采取sp2杂化;(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为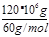 ×22.4L/mol×10-3m3=4.48×104m3;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+;
×22.4L/mol×10-3m3=4.48×104m3;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+;
本题难度:一般
3、选择题 下列选项错误的是?
A.在NH4C1晶体中含有离子键和共价键
B.设想把“H2+Cl2
C.某反应△H>0,△S>0,该反应是个非自发反应
D.25℃时,NaNO2溶液的pH=8,c(Na+)-c(NO2-)=9.9×10-7mol·L-1
参考答案:C
本题解析:
答案:C
C.不正确,某反应△H>0,△S>0,△G=△H―T△S在温度较高时,该反应是个自发反应。A、正确,NH4+与Cl―之间是离子键,N―H之间是共价键;B、正确,“H2+Cl2?2HCl”是自发的氧化还原反应;D、正确,由电荷守恒可得:c(Na+)-c(NO2-)= c(OH―)-c(H+ )=9.9×10-7mol·L-1
本题难度:一般
4、简答题 为测定某碳酸钠样品的纯度,取一定量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况).计算:
(1)该碳酸钠样品中碳酸钠的质量.
(2)盐酸的物质的量浓度.
参考答案:n(CO2)=0.224L22.4L/mol=0.01mol,反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,则
Na2CO3+2HCl=2NaCl+CO2↑+H2O
12 1
n(Na2CO3)n(HCl)0.01mol
n(Na2CO3)=0.01mol
n(HCl)=0.02mol,
(1)m(Na2CO3)=0.01mol×106g/mol=1.06g,
答:该碳酸钠样品中碳酸钠的质量为1.06g.
(2)c(HCl)=0.02mol0.04L=0.5mol/L,
答:盐酸的物质的量浓度为0.5mol/L.
本题解析:
本题难度:一般
5、选择题 学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是(?)
A.原子中核内质子数和核外电子数一定相等
B.溶液稀释前后溶质的质量一定相等
C.中和反应中参加反应的酸和碱质量一定相等
D.物质发生化学变化前后,元素的种类一定相等
参考答案:C
本题解析:中和反应中参加反应的酸和碱质量不一定相等,例如1mol盐酸和1mol氢氧化钠恰好中和,但盐酸的质量是36.5g,而氢氧化钠的质量是40g,选项C不正确,其余选项都是正确的,答案选C。
本题难度:一般