| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《有关氧化还原反应的计算》高频考点特训(2019年练习版)(八)
参考答案:D 本题解析:A.1 molCu2S参加反应时有1mol×2×(2-1)+1mol×[6-(-2)]=10mol电子转移,故A错误;B.由2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O可知,参加反应的n(Cu2S):n(HNO3)=2:14,故B错误;C.Cu、S元素的化合价升高,Cu2S做还原剂,故C错误;D.由发生的反应可知,产物n[Cu(NO3)2]:n[CuSO4]=1:1,故D正确;故选D。 本题难度:一般 2、选择题 乙二酸可以被强氧化剂氧化为CO2,现有0.10mol/L乙二酸溶液20mL,恰好被4×10-3molVO2+ 所氧化,则此反应的还原产物VOn+中n的值为( ) |
参考答案:D
本题解析:VOn+中V的化合价为+(n+2),氧化还原反应中得失电子数相等,所以0.10mol/L×0.02L×(4-3)×2=4×10-3mol×[5-(n+2)],5-(n+2)=1,所以n=2,故选D。
考点:考查氧化还原反应的计算
本题难度:一般
3、选择题 下列化学用语书写正确的是(?)
A.次氯酸的结构式:H-Cl-O
B.氯化镁的电子式:
C.作为相对原子质量测定标准的碳核素: 614C
D.用电子式表示氯化氢分子的形成过程:
参考答案:B
本题解析:次氯酸的结构式是H-O-Cl,A不正确;作为相对原子质量测定标准的碳核素是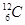 ,选项C不正确;氯化氢是共价化合物,D不正确,应该是
,选项C不正确;氯化氢是共价化合物,D不正确,应该是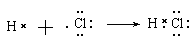 ,答案选B。
,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般
4、填空题 “氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2 (g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。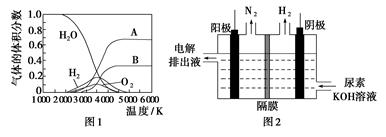
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
参考答案:(1)CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=165.0 kJ·mol-1
(2)为H2S热分解反应提供热量
2H2S+SO2=2H2O+3S↓(或4H2S+2SO2=4H2O+3S2↓)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(5)2Mg2Cu+3H2 MgCu2+3MgH2
MgCu2+3MgH2
本题解析:(1)根据盖斯定律将第一个热化学方程式扩大两倍再减去第二个热化学方程式即得该热化学方程式,ΔH也进行相应的计算得ΔH=206.2 kJ·mol-1×2-247.4 kJ·mol-1=165.0 kJ·mol-1。
(2)硫化氢燃烧放热,为其分解提供能量。硫化氢和二氧化硫反应生成单质硫和水。
(3)1 mol H2O分解首先得到2 mol H和1 mol O,故曲线A为H,曲线B为O。
(4)根据装置图可知阳极产生了N2,阴极产生了H2,再分析元素化合价的升降,可知阴极H+得电子生成氢气,在阳极[CO(NH2)2]失电子生成N2,同时再结合电荷守恒和质量守恒可知还生成CO32-。
(5)根据原子守恒和金属元素氢化物中氢的质量分数为0.077可判断,该金属元素的氢化物为MgH2。
本题难度:困难
5、选择题 将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O=2HBr+H2SO4,反应中转移的电子数和还原剂是
A.2e-,H2SO4
B.4e-,SO2
C.2e-,Br2
D.2e-,SO2
参考答案:D
本题解析:SO2中S的化合价从+4价升高到+6价,转移2个电子,所以SO2是还原剂,答案选D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《醇》高频试.. | |