1、选择题 在x mol石英晶体中,含有Si-O键数是
A.x mol
B.2x mol
C.3 x mol
D.4x mol
参考答案:D
本题解析:在石英晶体中,一个Si与4个O相连接,故x mol石英晶体中,含有Si-O键数是4x mol,故选D2的结构
点评:本题考查的是SiO2的结构的相关知识,题目难度不大,掌握SiO2的结构的特点是解答此类问题的根据。
本题难度:一般
2、选择题 下列有关化学键、氢键和范德华力的叙述中,不正确的是( )
A.金属键是金属离子与“电子气”之间的较强作用,金属键无方向性和饱和性
B.共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性
C.范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大
D.氢键不是化学键而是分子间的一种作用力,所以氢键只存在于分子与分子之间
参考答案:D
本题解析:氢键是一种分子间作用力,比范德华力强,但是比化学键要弱。氢键既可以存在于分子间(如水、乙醇、甲醇、液氨等),又可以存在于分子内(如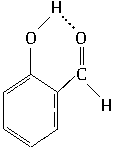 ),所以应选择D选项。
),所以应选择D选项。
本题难度:简单
3、选择题 食盐晶体的结构示意图如下图所示。已知食盐的密度为ρg·cm-3,摩尔质量为Mg·mol-1,阿伏加德罗常数 为NA,则在食盐晶体中Na+和Cl-间距大约是
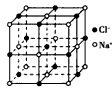
[? ]
A.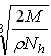 cm
cm
B.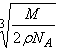 cm
cm
C.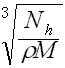 cm
cm
D.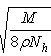 cm
cm
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列晶体中不属于原子晶体的是?
A.干冰
B.金刚砂
C.金刚石
D.水晶
参考答案:A
本题解析:A项:干冰即二氧化碳,属于分子晶体,不属于原子晶体。故选A。
点评:本题考查的是分子晶体和原子晶体的判别,题目难度不大,掌握常见物质晶体类别是解题关键。
本题难度:一般
5、选择题 下列有关晶体的叙述中错误的是
A.离子晶体中一定存在离子键
B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高
D.稀有气体的原子能形成分子晶体
参考答案:C
本题解析:离子晶体,是指离子间通过离子键结合形成的晶体,故A正确;原子晶体,是指相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体,故B正确;金属晶体是由金属元素构成的晶体,其熔沸点有的很高,如钨、铂等,有的则很低,如汞、镓等,故C错误;稀有气体的单质都是单原子分子,它们不能形成化学键,只能以微弱的分子间作用力结合,故形成分子晶体,D正确。
点评:晶体结构与性质在高考中考查难度并不大,考生在备考中主要掌握各类晶体的概念及其主要性质。
本题难度:一般