1、选择题 下列反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A.SO2(g)+NO2(g)  SO3(g)+NO(g)△H<0
SO3(g)+NO(g)△H<0
B.C(s)+CO2(g)  2CO(g)△H>0
2CO(g)△H>0
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)△H<0
4NO(g)+6H2O(g)△H<0
D.H2S(g)  H2(g)+S(s)△H>0
H2(g)+S(s)△H>0
参考答案:B
本题解析:略
本题难度:简单
2、计算题 (12分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2及固体催化剂,使之反应。已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量 ( ? )
A.小于92.2 kJ ? B.等于92.2 kJ ? C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数? ( ? )
A.等于0.25 ? B.大于0.25 ? C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充入N2的物质的量a mol的取值范围是_________________________________________。
(4)如图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。
参考答案:(12分)? (1)B ? 3分? (2)C? 3分? (3)1<a≤2? 3分
(4) 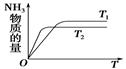 ?3分
?3分
本题解析:(1)? N2(g)+3H2(g)  2NH3(g)
2NH3(g)
起始量(mol)? 2? 8? 0
转化量(mol)? x? 3x? 2x
平衡量(mol)? 2-x? 8-3x?2x
所以有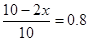 ,解得x=1,所以生成氨气是2mol,则发出热量是92.2 kJ,答案选B。
,解得x=1,所以生成氨气是2mol,则发出热量是92.2 kJ,答案选B。
(2)2 mol NH3、1 mol H2相当于是2mol、4mol氢气。由于反应是体积减小的可逆反应,所以产生相当于在用来的基础上减压,平衡向逆反应方向移动,所以氨气的分数小于0.25,答案选C。
(3)根据(1)可知,平衡时氮气是1mol,所以要使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则氮气的物质的量不需满足1<a≤2。
(4)温度高,反应速率快,达到平衡的时间少。但平衡向逆反应方向移动,所以图像为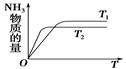 。
。
本题难度:一般
3、填空题 如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:
2SO2(g)+O2(g)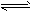 2SO3(g);ΔH < 0。该反应达到平衡状态A 时,测得气体总物质的量为
2SO3(g);ΔH < 0。该反应达到平衡状态A 时,测得气体总物质的量为
4.2mol。若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
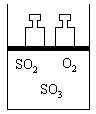
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数___________(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:____________或
__________。
(2)若起始时a =1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时
c的取值为__________。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围为__________。
参考答案:(1)减小;通入适量SO2;给体系升温
(2)任意值
(3)3.6<c≤4
本题解析:
本题难度:一般
4、填空题 (1 0分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)
0分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0?;试回答下列问题:
CO2(g)+H2(g) △H<0?;试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L -1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=?
-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=?
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1,c(CO)=c(CO2)="1" mol·L-1, c(H2)="1.5" mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),此时v(正)?v(逆)(填“ 大于”、“小于”或“等于”)。
大于”、“小于”或“等于”)。
(3)若降低温度,该反应的K值将?,该反应的化学反应速率将?(均填“增 大”“减小”或“不变”)。
大”“减小”或“不变”)。
参考答案:

本题解析:略
本题难度:一般
5、选择题 下列变化不能用勒夏特列原理解释的是?
A.向H2S水溶液中加入NaOH有利于S2-增多
B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
参考答案:B
本题解析:答案:B
B中H2+I2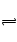 2HI是反应前后体积不变的反应,加压的平衡不移动,但体积缩小,所有物质的浓度均增加,是物理变化。
2HI是反应前后体积不变的反应,加压的平衡不移动,但体积缩小,所有物质的浓度均增加,是物理变化。
A H2S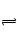 H++HS―,HS―
H++HS―,HS―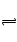 H++S2―加NaOH减小H+ 浓度,利于S2―的生成
H++S2―加NaOH减小H+ 浓度,利于S2―的生成
C合成氨时将氨液化分离,减小生成物浓度,平衡向正向进行;
D 中存在Cl2+H2O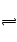 HClO+HCl,2HClO=2HCl+O2↑新制氯水久置后,HclO分解,促进Cl2与H2O的反应向正向进行,颜色变浅
HClO+HCl,2HClO=2HCl+O2↑新制氯水久置后,HclO分解,促进Cl2与H2O的反应向正向进行,颜色变浅
本题难度:一般