1、选择题 下列装置所示的实验中,能达到实验目的的是?(?)。 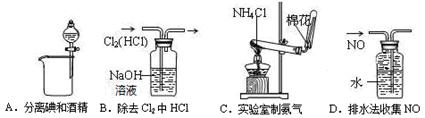
参考答案:D
本题解析:碘易溶在酒精中,不能直接分液,A不正确;B中的氢氧化钠溶液也能吸收氯气,不正确,应该用饱和的食盐水;氯化氢加热分解生成氯化氢和氨气,冷却后二者又化合生成氯化铵,C不正确;NO不溶于水,可以用排水法收集,D正确,答案选D。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
2、选择题 有关化学实验的下列操作中,一般情况下须相互接触的是( )
A.蒸馏操作中,温度计与烧瓶中的液体
B.过滤操作中,漏斗颈与烧杯内壁
C.分液操作中,分液漏斗颈与烧杯内壁
D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁
参考答案:A、蒸馏实验控制的是蒸气的温度,温度计水银球放在蒸馏烧瓶的支管口处,故A错误;
B、过滤操作中为防止滤液飞溅,漏斗颈紧贴烧杯内壁,故B正确;
C、分液操作中,分液漏斗颈要紧贴烧杯内壁,故C正确;
D、用胶头滴管向试管滴液体时,滴管要竖直悬空,滴管尖端不能接触试管内壁,故D错误.
故选BC.
本题解析:
本题难度:一般
3、选择题 下列实验方案合理的是 (? )
A.在镀件上电镀铜时,可用金属铜做阳极,用盐酸做电解质溶液
B.往碘化银沉淀中滴加氯化钠溶液,使碘化银沉淀转化为氯化银
C.制备FeCl3 溶液时,先将固体溶于较浓的盐酸,再加水稀释
D.用湿润的PH试纸测量某酸溶液的PH,测出溶液的酸碱性
参考答案:C
本题解析:略
本题难度:一般
4、实验题 (12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+—— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
滴定次数
实验数据
| 1
| 2
| 3
|
V(样品)/mL
| 20.00
| 20.00
| 20.00
|
V(KMnO4)/mL(初读数)
| ?0.00
| ?0.20
| ?0.00
|
V(KMnO4)/mL(终读数)
| 15.85
| 15.22
| 14.98
|
[交流与讨论]
(1)准备的实验用品中,不需要的仪器有(填序号)?;不需要的试剂有(填序号)?。
(2)本实验所用的KMnO4标准溶液的物质的量浓度为?。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是?(填字母序号)。
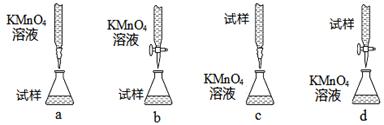
(4)判断滴定终点的依据是?。
(5)根据实验数据,计算该补血剂中铁元素的含量?。
参考答案:(1)c,e,j? c,d,f?(2)1.200×10-2 mol·L-1
(3)b?(4)滴入最后一滴KMnO4溶液恰好由无色变浅紫红色,且半分钟内不褪色
(5)16.8%
本题解析:(1)根据实验过程可知,不需要的仪器是c,e,j。高锰酸钾溶液具有氧化性,且显紫红色,所以不需要的试剂是c,d,f,
(2)0.474 g KMnO4晶体的物质的量是0.474g÷158g/mol=0.003mol,所以其浓度为0.003mol÷0.25L=1.200×10-2 mol·L-1。
(3)酸性高锰酸钾溶液不能用碱式滴定管,ac不正确。所以答案选b。
(4)酸性高锰酸钾溶液显紫红色,所以当滴入最后一滴KMnO4溶液恰好由无色变浅紫红色,且半分钟内不褪色,即说明达到滴定终点。
(5)三次实验中消耗高锰酸钾溶液的体积分别是15.85ml、15.02ml、14.98ml,因此第一次实验数据不能用,后两次的平均值是15.00mol。因此消耗高锰酸钾的物质的量是0.015L×1.200×10-2 mol·L-1=0.00018mol,得到电子是0.00018mol×5=0.0009mol,所以根据电子的得失守恒可知,亚铁离子的物质的量0.0009mol,质量是0.0009mol×56g/mol=0.0504g,所以该补血剂中铁元素的含量是0.0504g×5÷1.5g×100%=16.8%。
本题难度:一般
5、选择题 如图所示,下列实验操作方法正确的是
[? ]
A.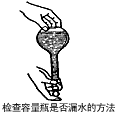
B.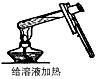
C.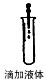
D.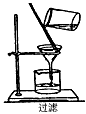
参考答案:A
本题解析:
本题难度:简单