1、选择题 下列说法正确的是
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱
参考答案:C
本题解析:同周期自左向右,原子半径逐渐减小,非金属性逐渐增强,则选项AB都是错误的。同主族自上而下金属性逐渐增强,非金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐增强,但非金属元素氢化物的稳定性逐渐降低,所以选项C正确,D错误,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题侧重对基础性知识的巩固与检验,有利于培养学生灵活运用元素周期律解决实际问题的能力,提高学生的应试能力。
本题难度:一般
2、填空题 下表为元素周期表的一部分。请回答下列问题:

根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
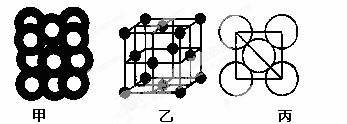
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为?,该晶体的密度为?(用字母表示)
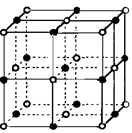
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:
离子晶体
| NaCl
| KCl
| CaO
|
晶格能/kJ·mol-1
| 786
| 715
| 3401
|
?
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:?(用化学式填写)。
其中⑧的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有?个。
参考答案:(1)H? Mg? Ca(2) 或
或 (3)大于
(3)大于
(4)四面体?极性?先产生蓝色沉淀,后溶解得深蓝色溶液
(5)12? (6)TiN>MgO>CaO>KCl? 6
(6)TiN>MgO>CaO>KCl? 6
本题解析:根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)区的名称来自于按照构造原理最后填入电子的轨道名称,所以根据元素的核外电子排布可知,上述元素中,属于s区的是H、Mg、Ca。
(2)氧元素的最外层电子数是6个,所以基态原子的价电子排布图是 或
或 。
。
(3)由于Mn元素的3d能级有5个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素的,所以Mn元素的第一电离能大于铁元素的第一电离能。
(4)根据价层电子对互斥理论可知,氨气分子中氮元素含有的孤对电子对数=(5-3×1)÷2=1,所以氨气的VSEPR模型为四面体;但实际的空间构型是三角锥形,所以该分子为极性分子。由于铜离子能和氨气形成配位健,所以向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为先产生蓝色沉淀,后溶解得深蓝色溶液。
(5)根据金属铝的晶胞可知,该晶胞的配位数是(3×8)÷2=12个,晶胞含有铝原子的个数是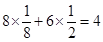 。根据丙的结构可知,该晶胞的边长是
。根据丙的结构可知,该晶胞的边长是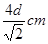 ,所以有
,所以有 ,因此晶胞的密度
,因此晶胞的密度 g/cm3。
g/cm3。
(6)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>MgO,MgO>CaO,由表中数据可知CaO>KCl,因此熔点从高到低的顺序是TiN>MgO>CaO>KCl。氯化钠的配位数是6个,即上下、左右和前后各1各,所以Ca的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有6个。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。该题的难点是晶体密度的计算。
本题难度:一般
3、选择题 X、Y均为元素周期表中前18号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.X、Y一定不是同周期元素
B.X2+的氧化性一定大于Y+
C.由mXa-与nYb+得,m-a=n+b
D.若气态氢化物的稳定性HmX大于HnY,则m>n
参考答案:B
本题解析:A不正确,例如氯离子和硫离子等。如果是金属,则X和Y一定位于同一周期,根据离子所带电荷数可知,X的原子序数大于Y的,因此X的金属性弱于Y的,所以X2+的氧化性一定大于Y+,B正确。C中应该是m+a=n-b,不正确。非金属性越强,相应氢化物的稳定性越强,则D中X的非金属性强于Y的,由于X和Y位于同一周期,所以X的原子序数大于Y的,因此m小于n,D不正确。答案选B。
本题难度:一般
4、填空题 (10分)下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。

(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_______(写元素符号);g、h、i第一电离能由大到小的顺序为______。(用元素符号表示)
(2)e元素原子结构示意图为_____?__。d元素原子核外电子排布式为_____?__。
(3)a的阴离子半径__?__b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物分别与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)______? _______?__________;___________?________________。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为_____________?_________________________。
(6)元素周期表中第6周期中的镧系元素共有?种,它们原子的电子层结构和性质十分相似。
(7)元素k的氢化物乙可由两种10个电子的微粒组成的化合物甲(化学式X3Y2)与水剧烈反应能生成。甲与水反应的化学反应方程式为:____? ___。
参考答案:(1)Xe? ;? He? Kr? Xe?(2)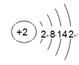 ? [Ar]3d104s1?
? [Ar]3d104s1?
(3)大于?(4)Be2++2OH?= Be(OH)2↓; Be2++4OH? =BeO2-+2H2O;
(5)PbO2+4HCl(浓)= PbCl2+Cl2↑+2H2O?(6)15?
(7)Mg3N2+6H2O=3Mg(OH)2+2NH3 ↑
本题解析:根据元素周期表可知,a是H,b是Be,c是Al,d是Cu,e是Fe,f是Pb,g是He,h是Kr,i是Xe,j是F,k是N。
(1)同族元素随着原子序数增加半径的增大,原子核对核外电子的束缚能力减弱,所以变得活泼,因此Xe是首先被发现参加化学反应的元素,第一电离能He>Kr>Xe。
(2)Fe的原子结构示意图为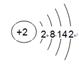 ,Cu原子核外电子排布式为[Ar]3d104s1。
,Cu原子核外电子排布式为[Ar]3d104s1。
(3)H-和Be2+具有相同的电子层结构,核电核数越大半径越小,所以H-大于Be2+。
(4)Be和Al处于对角线,因此性质相似,所以Be(OH)2具有两性,BeCl2分别与少量少量和过量的NaOH溶液反应的离子方程式为:Be2++2OH?= Be(OH)2↓和Be2++4OH? =BeO2-+2H2O。
(5)PbO2与浓盐酸的反应为PbO2+4HCl(浓)= PbCl2+Cl2↑+2H2O
(6)镧系共有元素15种。
(7)化合物甲为Mg3N2,化合物乙为NH3,Mg3N2与水反应的方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3 ↑。
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 下列离子中外层d轨道达半充满状态的是(? )
A.24Cr3+
B.26Fe3+
C.27Co3+
D.29Cu+
参考答案:B
本题解析:24Cr3+的外围电子排布式为:3d34s0,26Fe3+的为:3d54s0;27Co3+:3d64s0,故B正确。
本题难度:简单